Ржавчина - это проблема, с которой сталкиваются многие владельцы металлических изделий и конструкций. Она не только портит внешний вид материала, но и может привести к его разрушению. Для борьбы с ржавчиной используются различные методы, одним из которых является электролиз.
Электролиз - это процесс, основанный на использовании электрического тока для удаления ржавчины с металла. Возможность проведения электролиза обусловлена тем, что ржавчина - это окисление железа, которое можно разложить под воздействием электрического тока.
Принцип действия электролиза очень прост. Металлический предмет, покрытый ржавчиной, выступает в качестве положительного электрода, а отрицательный электрод (анод) размещается рядом с предметом, но не соприкасается с ним. При подаче электрического тока ржавчина под действием анода разлагается на ионы железа и кислорода. Ионы железа образуют отложения на отрицательном электроде, который можно легко смыть, восстановив таким образом металл в исходное состояние.
Что такое электролиз и как он помогает очищать металл от ржавчины?

Электролиз - это процесс, основанный на применении электрического тока для преобразования химических соединений. В случае очистки металла от ржавчины, электролиз используется для удаления окиси и других загрязнений с поверхности металла.
В процессе электролиза ржавчина на поверхности металла становится положительно заряженным ионом, альфа-частицы, кислород и другие загрязнения. Затем, при помощи электрического тока, ионы альфа-частиц перемещаются на катод, где происходит их нейтрализация.
Очищение металла от ржавчины методом электролиза имеет ряд преимуществ. Во-первых, этот процесс позволяет удалить ржавчину с самых труднодоступных мест на поверхности металла. Во-вторых, он не повреждает сам металл, так как происходит только окисление ржавчины и загрязнений, не затрагивая основу металла.
Для проведения электролиза металлический предмет, загрязненный ржавчиной, помещается в специальный раствор, называемый электролит. Раствор содержит ионы, которые реагируют с ржавчиной и загрязнениями на поверхности металла, образуя ионы ржавчины. Затем происходит подача электрического тока, который "выталкивает" ионы ржавчины из металла и переносят их в раствор.
В итоге, благодаря электролизу, металл освобождается от ржавчины и восстанавливает свой первоначальный вид и свойства. Такой метод очистки является эффективным и широко используется в промышленности для восстановления металлических изделий и поверхностей.
Принцип работы электролиза
Процесс электролиза основан на применении электрического тока для разложения химических соединений на составляющие ионы. В случае очистки металла от ржавчины, электролиз используется для удаления оксидных слоев, восстанавливая металлическую поверхность.
Процесс электролиза происходит в специальном растворе, называемом электролите, в состав которого обычно входят соли или кислоты. Электролит обеспечивает проводимость электрического тока и обмен ионами между анодом и катодом.
В электролизере, анод и катод размещаются в электролите таким образом, чтобы металл, подвергаемый очистке, был соединен с анодом. Под действием электрического тока, анод окисляется, освобождая окисленные ионы, которые перемещаются к катоду.
На катоде происходит противоположная реакция – осаждение металлических ионов на поверхность очищаемого металла. Таким образом, ржавчина и оксидные слои удаляются, а металл восстанавливается в своем первоначальном состоянии.
Преимуществом электролиза в очистке металла от ржавчины является его высокая эффективность и точность воздействия. Также электролиз позволяет работать с различными металлами и обрабатывать сложные формы поверхности, так как процесс не требует механического воздействия на материал.
Эффективность электролиза для очистки металла от ржавчины
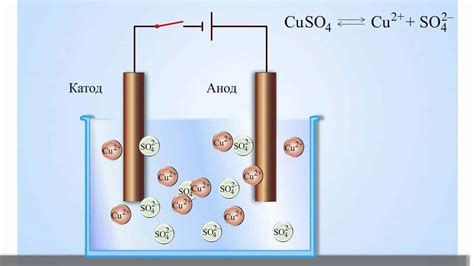
Электролиз является эффективным и широко применяемым методом для очистки металла от ржавчины. Он основан на передаче электрического тока через водную или другую электролитическую среду, что позволяет удалять оксиды и коррозию с металлической поверхности.
Процесс электролиза основан на использовании двух электродов - анода и катода, которые помещаются в электролитическую среду. Металлический предмет, покрытый ржавчиной, служит анодом, а катодом может быть проволочная сетка или другой металл, не подверженный коррозии. При подаче электрического тока на анод и катод происходит реакция, в результате которой оксиды и ржавчина переносятся с поверхности металла на анод, а на катоде образуется неподверженная коррозии пленка.
Преимуществом электролиза является его высокая эффективность в очистке металла от ржавчины. Он позволяет удалить даже глубоко закоррозированные слои с поверхности изделий. Кроме того, электролиз требует минимальных усилий и не использует агрессивные химические вещества, что делает его безопасным для окружающей среды и здоровья человека.
При проведении электролиза можно использовать различные электролитические растворы, в зависимости от типа металла, который необходимо очистить. Например, для очистки железных изделий от ржавчины можно использовать раствор соды или натрия, а для медных изделий - раствор серной кислоты. Это позволяет настроить процесс очистки под конкретные требования и получить оптимальные результаты.
Таким образом, электролиз является эффективным и безопасным методом очистки металла от ржавчины. Он применяется широко в различных отраслях промышленности и бытовой сфере, позволяя восстановить первоначальный вид и функциональность металлических изделий.
Вопрос-ответ

Какая роль играет электролиз в очистке металла от ржавчины?
Электролиз – это эффективный способ очистки металла от ржавчины. При электролизе между металлическим предметом и ванной с электролитом создается электрический ток, который активно удаляет ржавчину и восстанавливает поверхность металла.
Как можно очистить металл от ржавчины с использованием электролиза?
Для очистки металла от ржавчины с помощью электролиза можно использовать простую ванну с электролитом. Металлический предмет, покрытый ржавчиной, является анодом, а катодом служит другой металлический предмет. При подаче электрического тока через электролит на аноде происходит окисление ржавчины, которая затем отслаивается, а на катоде растворяются ионны металла, которым покрыт анод.
