Электролитическая диссоциация, являющаяся одним из основных процессов в химии, играет важную роль при реакциях различных веществ. Особое внимание придается кислотам, которые под воздействием электрического тока распадаются на ионы. При этом образуются различные ионы, включая металлические катионы, которые являются положительно заряженными частицами.
В процессе электролитической диссоциации образование металлических катионов происходит благодаря переносу заряда от кислоты к катоду. Катод, являющийся отрицательно заряженным электродом, притягивает положительные ионы, в данном случае металлические катионы. При этом кислота распадается на отрицательно заряженные анионы и положительно заряженные катионы металла. Отрицательно заряженные анионы, в свою очередь, движутся к аноду, положительно заряженному электроду.
Металлические катионы, образующиеся при электролитической диссоциации кислот, являются важными компонентами различных химических процессов. Они могут быть использованы для проведения электрохимических реакций, а также для получения и очистки металлов. Эта способность катионов к металлической форме имеет большое значение при производстве различных материалов, таких как сплавы или покрытия.
Механизм электролитической диссоциации кислот
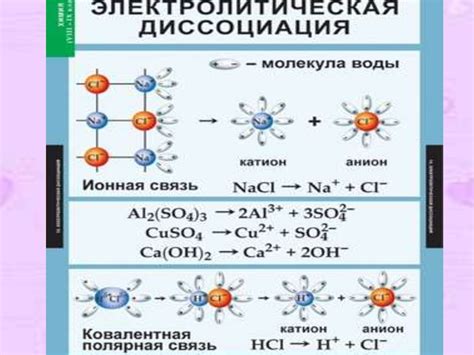
Электролитическая диссоциация кислот - это процесс, в результате которого кислота разделяется на ионы в растворе под воздействием электрического тока. Основными участниками этого процесса являются молекулы кислоты и молекулы воды.
Вначале молекула кислоты вступает в реакцию с молекулой воды, а именно происходит аддиция воды к молекуле кислоты, с образованием гидроксония и аниона кислоты. Гидроксоний и ион кислоты являются ионами, которые могут двигаться в растворе и проводить электрический ток.
Затем происходит процесс диффузии ионов в растворе, когда ионы гидроксония и анионы кислоты размещаются в растворе равномерно. Под воздействием электрического тока, ионы гидроксония (H3O+) и анионы кислоты (A-) перемещаются к аноду и катоду соответственно.
На аноде происходит окисление ионов гидроксония, при этом они отдают свои электроны и образуют молекулы воды и молекулы кислоты. На катоде происходит восстановление анионов кислоты, электроны, поступающие на катод, передаются анионам кислоты, что приводит к образованию молекул кислоты.
Таким образом, механизм электролитической диссоциации кислот заключается в реакции кислоты с водой, движении ионов в растворе под воздействием электрического тока и регенерации молекул кислоты в результате окисления и восстановления ионов.
Образование металлических катионов при диссоциации кислот

Диссоциация кислот является важным процессом в химии. При этом процессе кислоты разделяются на ионы, что приводит к образованию катионов. Металлические катионы образуются при диссоциации кислот, содержащих металлические ионы в своей структуре.
Диссоциация кислот происходит в водных растворах, где вода действует в качестве растворителя. Вода образует гидрональные ионы H+ и OH-, которые вступают в реакцию с кислотами. Гидрональные ионы H+ образуются в результате протонирования кислоты, то есть присоединения протона к молекуле кислоты.
Металлические катионы образуются при диссоциации кислот, содержащих металлические элементы. Например, при диссоциации серной кислоты (H2SO4), образуются два катиона: один протонный катион H+ и второй металлический катион, который зависит от металла в составе кислоты, например, SO4^2-.
Образование металлических катионов при диссоциации кислот играет важную роль в многих химических процессах. Металлические катионы могут быть использованы в качестве катализаторов, электролитов, а также они участвуют в образовании сложных соединений и комплексов. Поэтому изучение диссоциации кислот и образование металлических катионов имеет практическое значение для различных областей науки и технологий.
Роль катионов в процессе электролиза
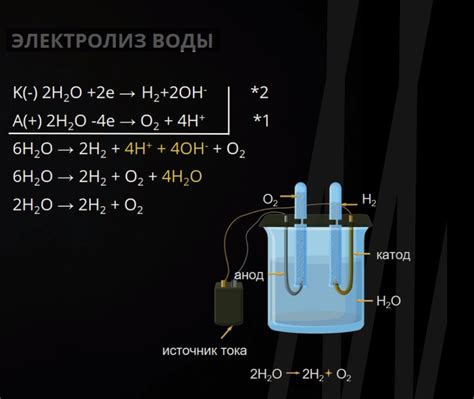
В процессе электролиза катионы играют важную роль, так как они ответственны за передачу положительного заряда через электролит. Катионы - это положительно заряженные ионы, которые образуются при электролитической диссоциации кислот.
Одной из основных функций катионов является перемещение положительного заряда от анода к катоду. Это происходит благодаря электрическому полю, создаваемому внешним источником тока. Катионы проводят электрический ток через электролит, перемещаясь в противоположном направлении от анода к катоду.
Помимо транспортировки заряда, катионы также могут участвовать в химических реакциях на электроде. Например, они могут осаждаться на поверхностях электродов, приводя к образованию металлического отложения. Это явление называется электроосаждением и может быть использовано для получения различных металлических покрытий.
Также катионы могут взаимодействовать с анионами и другими реагентами в электролите, образуя новые химические соединения. Эти реакции могут происходить на поверхностях электродов и влиять на эффективность процесса электролиза. Поэтому контроль и манипулирование катионами является важной составляющей в процессе электролиза.
Применение металлических катионов в различных отраслях

Металлические катионы, образующиеся при электролитической диссоциации кислот, широко применяются в различных отраслях нашей жизни. Они играют важную роль в производстве, научных исследованиях и медицине.
Один из главных способов использования металлических катионов – это производство различных материалов и сплавов. Металлы, получаемые при диссоциации кислот, обладают различными свойствами, что позволяет создавать материалы с уникальными характеристиками. Например, медные и алюминиевые катионы используются для производства проводников и алюминиевых сплавов, которые широко применяются в электронике и строительстве.
Кроме того, металлические катионы играют важную роль в химической промышленности. Они используются в процессе каталитической диссоциации кислот, что позволяет получать различные продукты, такие как пластик, удобрения, красители и многие другие. Например, железные катионы широко применяются при производстве удобрений, так как они являются необходимым элементом для роста растений.
Металлические катионы находят применение и в медицине. Они используются при производстве лекарственных препаратов и добавок, так как они могут усилить их эффективность или обладать лечебными свойствами. Например, серебряные катионы широко применяются в антисептических и противогрибковых средствах.
Таким образом, металлические катионы, получаемые при электролитической диссоциации кислот, играют важную роль в различных отраслях. Они применяются в производстве материалов, химической промышленности и медицине, обладая уникальными свойствами и способностями.
Особенности электролитической диссоциации кислот в разных условиях

Электролитическая диссоциация кислот является процессом, при котором кислотные молекулы распадаются на ионы в растворе. В зависимости от условий, этот процесс может иметь свои особенности.
Первая особенность электролитической диссоциации кислот заключается в том, что она происходит только в растворах. Кислотные молекулы не диссоциируют в чистом виде, а лишь взаимодействуют с водой, образуя ионы. Именно это взаимодействие обеспечивает возможность электролитической диссоциации кислот и образования металлических катионов.
Другая особенность электролитической диссоциации кислот связана с их концентрацией. Более концентрированные растворы кислот имеют большую способность к диссоциации, что означает большее количество образующихся металлических катионов. Следовательно, при повышении концентрации кислоты, процесс электролитической диссоциации будет более интенсивным.
Также стоит отметить, что электролитическая диссоциация кислот зависит от температуры. При повышении температуры раствора, скорость диссоциации увеличивается, что приводит к большему образованию металлических катионов. Низкая температура, напротив, может замедлить процесс диссоциации и уменьшить количество образующихся ионов.
Таким образом, электролитическая диссоциация кислот имеет свои особенности в разных условиях, включая растворность, концентрацию и температуру. Это важный процесс, который позволяет получить металлические катионы, играющие значимую роль в различных химических реакциях и промышленных процессах.
Вопрос-ответ

Что такое электролитическая диссоциация кислот?
Электролитическая диссоциация кислот - это процесс, при котором молекулы кислот распадаются на ионы водных растворах. Кислотные молекулы превращаются в положительно заряженные ионы водорода (H+) и отрицательно заряженные анионы.
Какие ионы образуются при электролитической диссоциации кислот?
При электролитической диссоциации кислот образуются положительно заряженные металлические катионы, такие как H+ и ионы металлов, содержащиеся в составе кислоты. К примеру, при диссоциации соляной кислоты (HCl) образуются ионы H+ и Cl-.
Как происходит электролитическая диссоциация кислот?
Электролитическая диссоциация кислот происходит под влиянием воды. Вода является полярным растворителем, и молекулы воды образуют водородные связи с молекулами кислоты. Это приводит к разделению кислоты на положительно заряженные ионы водорода (H+) и отрицательно заряженные анионы кислоты.
