Электродный потенциал металла - важная характеристика, определяющая его способность вступить в химическую реакцию. Он измеряется вольтами и является мерой энергетической разницы между металлом и некоторым стандартным электродом.
Электродный потенциал металла является следствием его физико-химических свойств. Он зависит от электронной структуры металла, его состояния поверхности и взаимодействия с окружающей средой. Высокий электродный потенциал свидетельствует о том, что металл легко отдает электроны, тогда как низкий потенциал указывает на его большую способность принимать электроны.
Электродный потенциал металла играет важную роль в химической реакции. Металлы с разными электродными потенциалами могут вступать в анаэробные и окислительно-восстановительные реакции. В случае анаэробных реакций, при взаимодействии с растворами электролитов, металл с более высоким потенциалом будет отдавать электроны, а металл с более низким потенциалом - принимать их. В результате, электроны будут перемещаться по электроду, вызывая электрохимическую реакцию.
Значение электродного потенциала металла имеет практическое применение в различных областях, включая электрохимию, электроэнергетику и металлургию. Понимание электродного потенциала металла позволяет оптимизировать процессы в этих областях, разрабатывать новые материалы с желаемыми свойствами, а также предсказывать и контролировать химические реакции, происходящие с участием металлов.
Что такое электродный потенциал металла?
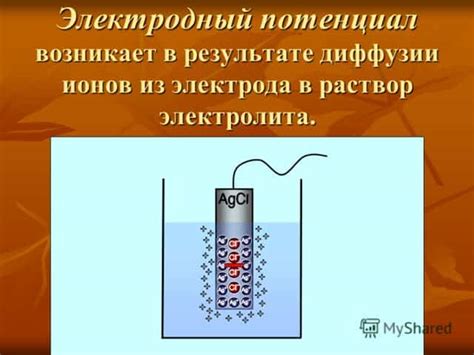
Электродный потенциал металла – это электрический параметр, характеризующий способность металла вступать в химическую реакцию с раствором электролита или другим металлом. Электродный потенциал может быть положительным, отрицательным или равным нулю, в зависимости от активности металла.
Чем выше электродный потенциал металла, тем легче происходит окислительно-восстановительная реакция с раствором электролита. Металлы с положительным значением электродного потенциала имеют большую склонность отдавать электроны и окисляться. Например, кальций имеет высокий электродный потенциал, поэтому он реагирует с водой или кислородом с выделением водорода.
Сравнение электродных потенциалов различных металлов позволяет составить электрорядный ряд, по которому можно определить, какие металлы будут реагировать с растворами электролитов. Металлы с наибольшими положительными значениями электродного потенциала будут самыми активными и легко окисляться, в то время как металлы с наименьшими или отрицательными потенциалами будут наиболее инертными.
Знание электродного потенциала металлов важно не только для понимания химических реакций, но и для выбора материала при создании различных электроприборов, а также применения в гальванических элементах и аккумуляторах.
Определение и основные понятия
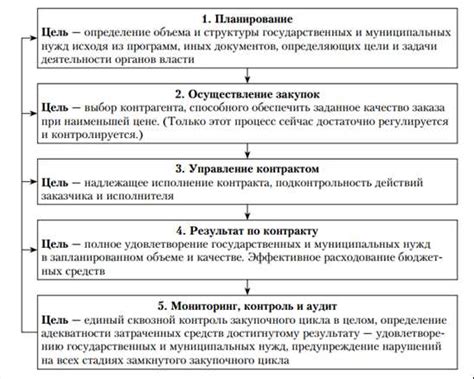
Электродный потенциал металла - это мера способности металла отдавать или принимать электроны при химической реакции или в химическом процессе. Он характеризует потенциальную разницу между металлом и стандартной водородной электродной половинкой.
Электродный потенциал металла определяется стандартным водородным электродом (сокращенно СВЭ), который принят в качестве основной точки отсчета. СВЭ имеет абсолютный электродный потенциал 0,00 В при стандартных условиях (температура 25°С, давление 1 атмосфера).
Когда электродный потенциал металла положительный, это означает, что металл легко отдает электроны и имеет склонность к окислению. Если электродный потенциал металла отрицательный, то металл имеет тенденцию принимать электроны и проявляет свойства восстановителя.
Электродный потенциал металла оказывает влияние на химическую реакцию. Если два металла с разными электродными потенциалами находятся в контакте, то возникает электродный потенциал раздела, который создает разность потенциалов и приводит к потоку электронов между металлами. Это явление называется гальванической или вольт-гальванической парой. Вольт-гальваническая пара является основой для работы аккумуляторов, гальванических элементов и других электрохимических устройств.
Какова роль электродного потенциала в химической реакции?

Электродный потенциал металла является важным показателем его способности взаимодействовать с другими веществами в химических реакциях. Этот потенциал определяет, насколько легко электроны могут переходить между металлом и другими веществами.
В химической реакции электродный потенциал металла определяет, будет ли металл окисляться или восстанавливаться. Металлы с более высоким электродным потенциалом имеют большую тенденцию к окислению, то есть отдавать электроны, в то время как металлы с более низким электродным потенциалом имеют большую тенденцию к восстановлению, то есть принимать электроны.
Электродный потенциал металла также влияет на скорость химической реакции. Металлы с более высоким электродным потенциалом имеют более активную поверхность и легче реагируют с другими веществами. Это объясняет, почему активные металлы, такие как натрий или калий, быстро реагируют с водой или кислородом.
Изучение электродного потенциала металла помогает предсказывать его поведение в химических реакциях. Например, знание электродного потенциала металла может помочь предсказать, будет ли металл растворяться в кислотах или образовывать стабильную пленку оксида на своей поверхности.
Коррозия и электродный потенциал
Коррозия – это процесс разрушения металлического материала под воздействием окружающей среды. Она может привести к существенным повреждениям и снижению срока службы металлических конструкций. Одним из факторов, влияющих на скорость коррозии, является электродный потенциал металла.
Каждый металл имеет свой электродный потенциал, который определяет его склонность к окислению или восстановлению. Металлы с более низким электродным потенциалом называются анодами, а металлы с более высоким – катодами. При контакте разных металлов в присутствии электролита (например, влаги или раствора) между ними возникает гальваническая пара, что приводит к коррозии анода.
Электродный потенциал металла может быть измерен по отношению к определенному эталону, например, к идеальной водородной электроде. Металлы с более положительным электродным потенциалом имеют более высокую склонность к восстановлению и меньшую склонность к коррозии, в то время как металлы с более отрицательным потенциалом более склонны к окислению и коррозии.
Понимание электродного потенциала металла позволяет выбирать подходящие материалы для конструкций с учетом условий эксплуатации, чтобы минимизировать риск коррозии. Также, контроль электродного потенциала и использование защитных покрытий и антикоррозионных покрытий помогают предотвратить разрушение металлических конструкций и продлить их срок службы.
Влияние электродного потенциала на протекание реакции

Электродный потенциал металла является важным параметром, оказывающим влияние на протекание химической реакции. Он определяет способность металла участвовать в окислительно-восстановительных реакциях и взаимодействие с другими веществами.
Металлы с различными электродными потенциалами могут образовывать спаренные электроды, на которых возникают электрохимические реакции. В таких реакциях один металл выступает в роли окислителя, который отдает электроны, а другой металл - в роли восстановителя, который принимает электроны.
Электродный потенциал определяет направление потока электронов и, следовательно, направление протекающей реакции. Металлы с более высоким электродным потенциалом будут иметь тенденцию окисляться и служить окислителем, а металлы с более низким потенциалом будут принимать электроны и действовать в качестве восстановителя.
Взаимодействие металлов с разными электродными потенциалами может приводить к образованию гальванических элементов или электрохимических пар. Такие системы могут использоваться для выработки электрической энергии или для защиты металлов от коррозии.
Электродные ряды металлов и их значение

Электродные ряды металлов представляют собой упорядоченный список металлов, упорядоченных по их электрохимической активности. Электродный потенциал каждого металла в ряду определяет его способность отдавать или принимать электроны в химической реакции.
Электродные ряды металлов имеют важное значение в химии и электрохимии. Они позволяют предсказать направление химических реакций, основанных на электронном переносе. Металлы с более высоким электродным потенциалом (более активные металлы) будут иметь большую склонность отдавать электроны и окисляться, тогда как металлы с более низким электродным потенциалом (менее активные металлы) будут иметь большую склонность принимать электроны и восстанавливаться.
Знание электродных рядов металлов позволяет определить правильный порядок реакций и предсказать возникновение различных электрохимических процессов. Например, на основе электродных рядов можно предсказать, будет ли металл растворяться в кислых или щелочных условиях, а также какие реакции могут происходить при контакте различных металлов.
Электродные ряды металлов также имеют практическое применение. Например, они используются для выбора правильного анодного материала в гальванических элементах или анодной защиты металлических конструкций от коррозии. Подбор материалов с различными электродными потенциалами позволяет создавать электрохимические системы с желаемыми свойствами и функциональностью.
Измерение электродного потенциала
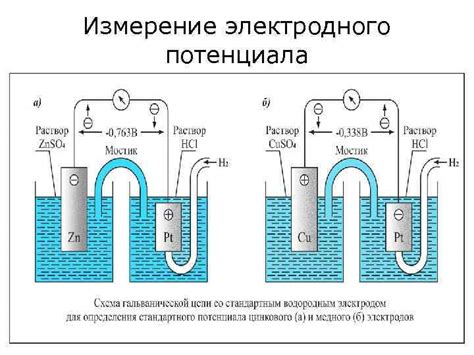
Электродный потенциал металла - это физическая характеристика металла, описывающая его способность проводить электрический ток относительно других веществ. Измерение электродного потенциала позволяет определить, насколько активным или инертным является данный металл в химических реакциях.
Для измерения электродного потенциала используются специальные приборы, называемые вольтметрами. Они позволяют измерять разность потенциалов между двумя электродами и определить, какой из них является более активным. Обычно для измерения электродного потенциала металла используют сравнительную электроду известного потенциала, такую как стандартный водородный электрод.
Для проведения измерений электродного потенциала металла, образец металла помещают в электролитическую ячейку, где он служит анодом или катодом, а проводимость измеряется описанными выше вольтметрами. Полученные данные позволяют оценить, какую химическую реакцию металл может совершать в данной системе и каковы его электрохимические свойства.
Применение электродного потенциала в практике

Электродный потенциал металла играет важную роль в различных практических приложениях. Например, в коррозионных процессах электродный потенциал металла является ключевым фактором, определяющим его склонность к окислению. Металлы с более низким электродным потенциалом нежелательно использовать в условиях, которые способствуют коррозии, поскольку они будут более активно реагировать с окружающей средой.
Кроме того, электродный потенциал металла играет важную роль в электрохимических реакциях. Например, в процессе электролиза электродный потенциал металла определяет его способность проводить электрический ток и участвовать в реакции. Металлы с более высоким электродным потенциалом будут склонны к окислению и станут положительными электродами, а металлы с более низким электродным потенциалом будут склонны к восстановлению и станут отрицательными электродами.
В промышленности довольно распространено применение электродного потенциала металла в гальванических элементах и аккумуляторах. Гальванические элементы используются для преобразования химической энергии в электрическую путем использования реакции окисления-восстановления. Электроды в таких системах выбираются с учетом их электродного потенциала и направления реакции. Аккумуляторы, в свою очередь, используются для хранения электрической энергии и также основаны на электродных потенциалах металлов.
Таким образом, понимание электродного потенциала металлов и его применение в практике позволяет оптимизировать использование материалов, улучшить электрохимические процессы и создать более эффективные электрохимические устройства.
Вопрос-ответ

Что такое электродный потенциал металла?
Электродный потенциал металла - это мера его способности передавать или принимать электроны при химической реакции. Он определяет активность металла и его склонность к окислению или восстановлению.
Как электродный потенциал металла влияет на химическую реакцию?
Электродный потенциал металла определяет его реакционную активность и его способность участвовать в окислительно-восстановительных реакциях. Металл с более высоким электродным потенциалом будет иметь большую склонность к окислению, тогда как металл с нижним электродным потенциалом будет склонен к восстановлению.
