Основным понятием, используемым в химических расчетах, является эквивалентная масса. Эквивалентная масса определяет количество вещества, содержащее один эквивалент (то есть, одну грамм-эквивалентную массу) данного вещества. Для разных веществ эквивалентная масса может быть различной, и это зависит от конкретной реакции или процесса.
При рассмотрении оксидов металлов особую роль играет эквивалентная масса оксида металла. Эквивалентная масса оксида металла, образующегося при реакции с водой или кислородом, может быть определена исходя из массы молярного количества соответствующего металла. В случае, когда 12 г металла реагирует с кислородом, образуется оксид металла массой, эквивалентной эквивалентной массе оксида металла.
Эквивалентная масса оксида металла может быть найдена с помощью метода соотношений между массами. Для этого необходимо учесть массовое отношение между металлом и его оксидом. Таким образом, эквивалентная масса оксида металла может быть рассчитана путем деления массы оксида на количество вещества металла, которое соответствует этой массе. В нашем случае, при реакции 12 г металла и кислорода, масса эквивалентной массы оксида металла будет равна 12 г.
Эквивалентная масса оксида: определение и формула расчета

Эквивалентная масса оксида является важным показателем, который позволяет определить количество оксида металла, образующегося из определенного молярного количества металла. Этот показатель позволяет установить соотношение между массой оксида и массой металла, из которого он образуется.
Для расчета эквивалентной массы оксида используется следующая формула:
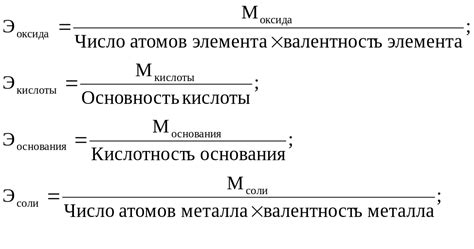
Эквивалентная масса оксида = молярная масса оксида / валентность металла
В данной формуле, молярная масса оксида обозначает массу одного моля оксида металла, а валентность металла - число электронов, которые данная частица может принять или отдать при взаимодействии с другими частицами.
Для определения эквивалентной массы оксида металла, образующегося из 12 г моль металла, необходимо знать молярную массу оксида и его валентность. Подставив значения в формулу, можно получить искомую эквивалентную массу.
Расчет эквивалентной массы оксида металла является важным шагом при определении количества оксида, который может образоваться из заданного молярного количества металла. Этот показатель также может использоваться для определения массы металла по известной массе оксида.
Эквивалентная масса: понятие и значение
Эквивалентная масса - это масса вещества, содержащего 1 моль или эквивалент элементов, и равная молекулярной массе, деленной на коэффициент вещества в уравнении реакции.
Эквивалентная масса имеет важное значение в химии, так как она позволяет определить количество вещества, образующегося или потребляющегося в химической реакции. Ее измерение особенно полезно при расчетах стехиометрии, определении массы вещества, участвующего в реакции.
Для расчета эквивалентной массы необходимо учитывать стехиометрическое соотношение элементов в реакции. Например, в случае образования оксида металла из 12 г моль металла, эквивалентная масса будет равна массе металла, деленной на число молей металла, участвующих в реакции.
Эквивалентная масса также позволяет сравнивать массу веществ, не зависимо от их молекулярной массы. Например, если эквивалентная масса фосфора составляет 31 г на моль, а эквивалентная масса кислорода - 16 г на моль, то при соединении одной молекулы фосфора с 3 молекулами кислорода образуется фосфорнокислородная группа, эквивалентная масса которой будет равна 31 г + 3 * 16 г = 79 г.
В заключение, эквивалентная масса является важным понятием в химии, позволяющим проводить расчеты веществ, участвующих в химических реакциях. Определение эквивалентной массы позволяет устанавливать соотношение элементов в реакции и оценивать их стехиометрическую роль в образующихся соединениях.
Оксид металла: структура и свойства

Структура оксида металла. Оксид металла представляет собой химическое соединение, состоящее из атомов металла и атомов кислорода. Он может иметь различную структуру в зависимости от особенностей взаимодействия атомов. Например, некоторые оксиды металлов образуют кристаллическую структуру, в которой атомы металла и кислорода укладываются в определенном порядке.
Свойства оксида металла. Оксиды металлов обладают рядом характеристических свойств. Во-первых, они обычно образуют твердые вещества с высокой температурой плавления. Во-вторых, оксиды металлов обычно обладают химической активностью. Они способны взаимодействовать с другими веществами, например, с водой или кислотами, и образовывать новые соединения. Кроме того, оксиды металлов могут проявлять сильные окрашивающие свойства и использоваться в качестве пигментов.
Примеры оксидов металлов. Примерами оксидов металлов являются оксид железа (Fe2O3), оксид алюминия (Al2O3) и оксид меди (CuO). Оксид железа образует красные кристаллы, оксид алюминия применяется в качестве катализатора, а оксид меди используется для окрашивания стекла и керамики. Каждый оксид металла имеет свою собственную структуру и свойства, что делает их уникальными веществами.
Использование оксидов металлов. Оксиды металлов имеют широкое применение в различных отраслях промышленности и научных исследованиях. Например, оксид железа используется в производстве стали, оксид алюминия играет важную роль в производстве керамики и стекла, а оксид меди применяется в электронике. Благодаря своим уникальным свойствам, оксиды металлов способствуют развитию различных технологий и находят применение во многих сферах человеческой деятельности.
Расчет эквивалентной массы оксида металла на примере 12 г моль металла

Эквивалентная масса оксида металла - это масса оксида, соответствующая 1 г атомов металла. Для расчета эквивалентной массы оксида металла необходимо знать массу металла, из которого образуется оксид, и молярную массу этого металла.
Рассмотрим пример с молью металла массой 12 г. Для начала, необходимо найти число молей металла в данной массе. Для этого воспользуемся формулой:
Число молей = масса / молярная масса
Зная массу металла (12 г) и его молярную массу, можно вычислить число молей металла в данной массе. Далее, используя соотношение, что в моле металла образуется 1 моль оксида, можно найти эквивалентную массу оксида металла.
Например, для расчета эквивалентной массы оксида металла, образующегося из 12 г моль металла, необходимо знать молярную массу этого металла. Пусть молярная масса металла составляет 24 г/моль. Тогда число молей металла будет:
Число молей = 12 г / 24 г/моль = 0.5 моль
Следовательно, эквивалентная масса оксида металла будет 12 г / 0.5 моль = 24 г.
Таким образом, эквивалентная масса оксида металла, образующегося из 12 г моль металла, составляет 24 г.
Примеры расчета эквивалентной массы оксида металла

Эквивалентная масса оксида металла определяется как масса данного оксида, образующаяся из одного эквивалента (или одного эквивалентного веса) металла. Расчет эквивалентной массы оксида металла можно выполнить, зная мольную массу металла и мольное отношение металла и кислорода в оксиде.
Для примера возьмем металл цинк (Zn) и его оксид - оксид цинка (ZnO). Масса мольная цинка равна 65,38 г/моль, а масса мольная кислорода - 16 г/моль. В молекуле оксида цинка находится 1 атом цинка и 1 атом кислорода. Отсюда можно сделать вывод, что массовое отношение цинка и кислорода в оксиде составляет 65,38 г/моль : 16 г/моль = 4,09 г/г.
Теперь произведем расчет эквивалентной массы оксида цинка. Для этого разделим массу молярную цинка на массовое отношение цинка и кислорода в оксиде: 65,38 г/моль : 4,09 г/г = 15,97 г/г. Полученное значение является эквивалентной массой оксида цинкка, образующегося из 1 эквивалента металла.
Таким образом, эквивалентная масса оксида металла в данном случае составляет 15,97 г/г, что означает, что для образования 12 г оксида цинка, необходимо 0,75 эквивалента (или 0,75 эквивалентного веса) цинка.
Вопрос-ответ

Что такое эквивалентная масса оксида металла?
Эквивалентная масса оксида металла - это масса оксида металла, которая содержит один эквивалент металла. Она определяется как масса металла, разделенная на количество эквивалентов металла в оксиде. Эквивалент - это количество вещества, равное молю атомов водорода в химическом соединении. Эквивалентная масса оксида металла играет важную роль в расчетах химических реакций и стохиометрических пропорциях.
Как вычислить эквивалентную массу оксида металла?
Эквивалентная масса оксида металла вычисляется путем деления массы металла на количество эквивалентов металла в оксиде. Для этого нужно знать химическую формулу оксида металла и соответствующую формулу металла. Например, если масса металла в оксиде составляет 12 г, а количество эквивалентов металла в оксиде равно 2, то эквивалентная масса оксида металла будет равна 6 г (12 г / 2 экв).
Какова эквивалентная масса оксида металла, образующегося из 12 г моль металла?
Для определения эквивалентной массы оксида металла необходимо знать химическую формулу металла и соответствующего оксида, а также количество эквивалентов металла в оксиде. Если предположить, что формула оксида металла имеет вид MO, где M - металл, то масса оксида металла будет равна сумме массы металла и кислорода. Если моль металла весит 12 г, то эквивалентная масса оксида металла будет равна молярной массе металла плюс молярная масса кислорода (16 г/моль). Таким образом, эквивалентная масса оксида металла будет равна (12 г/моль + 16 г/моль) = 28 г/моль.
Какие значения эквивалентной массы оксида металла могут быть в зависимости от типа металла?
Значения эквивалентной массы оксида металла могут различаться в зависимости от типа металла. Каждый металл имеет свою молярную массу и количество эквивалентов в оксиде может быть разным. Например, для двух различных металлов эквивалентные массы оксидов могут быть 28 г/моль и 40 г/моль. Это связано с различными мольными массами металлов и количеством эквивалентов в оксиде.
