Химия щелочных металлов является одной из важных тем Единого Государственного Экзамена по химии. Щелочные металлы включают в себя литий, натрий, калий, рубидий, цезий и франций. Они относятся к первой группе периодической системы элементов и являются наиболее активными из всех химических элементов. Щелочные металлы обладают своеобразными свойствами и имеют широкое применение в различных отраслях науки и промышленности.
Одной из характерных особенностей щелочных металлов является их высокая активность. Они реагируют с водой, кислородом, аммиаком и многими другими веществами. Реакция между щелочными металлами и водой особенно заметна, так как происходит образование газа в виде пузырьков и выделение большого количества тепла. Это явление называется "горение" металла. Для щелочных металлов характерным является также образование сильных щелочных растворов.
Химия щелочных металлов имеет большое значение для практического применения. Так, калий используется в сельском хозяйстве как удобрение, а также в производстве стекла и щелочей. Литий применяется в легкой промышленности, а рубидий и цезий находят применение в производстве и в научной сфере. Химия щелочных металлов широко распространена в жизни человека и изучается в рамках ЕГЭ по химии.
Подготовка к ЕГЭ по химии: основные темы
В подготовке к ЕГЭ по химии важно уделить достаточно времени изучению основных тем, которые могут встретиться на экзамене. Эти темы включают в себя такие понятия, как растворы, химические реакции, химические элементы и их свойства, а также щелочные металлы.
Щелочные металлы представляют особый интерес из-за их уникальных свойств и широкого спектра применений. Эти элементы находятся в первой группе периодической таблицы и включают в себя литий, натрий, калий, рубидий, цезий и франций. Щелочные металлы обладают характерным металлическим блеском, мягкостью и низкой плотностью.
Одной из важных особенностей щелочных металлов является их способность активно взаимодействовать с водой, образуя щелочные растворы. Это явление называется гидролизом. В результате реакции с водой щелочные металлы выделяют водород и образуют гидроксиды.
Кроме того, щелочные металлы применяются в различных областях науки и техники. Например, калий используется в сельском хозяйстве в качестве удобрения, а натрий используется в производстве стекла и щелочных батарей.
Химия щелочных металлов: основные понятия

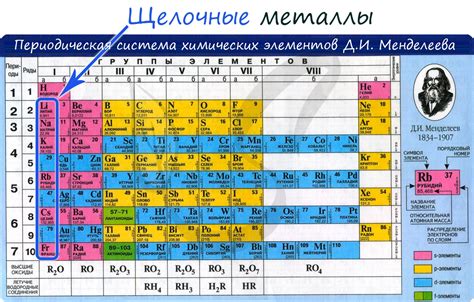
Щелочные металлы - это элементы из первой группы периодической системы, включающей литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они отличаются высокой реактивностью и химической активностью, а также обладают низкими температурами плавления и кипения.
Щелочные металлы обладают рядом характеристических свойств. Во-первых, они реагируют с водой, образуя щелочи и выделяя водород. Это реакция, которая происходит с выделением большого количества тепла. Во-вторых, они образуют ионы с положительным зарядом, легко отдают электроны и образуют ионы M+.
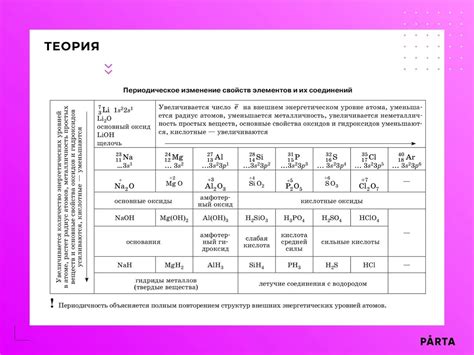
Щелочные металлы также являются самыми большими в группе, имеют наименьший радиус и наибольший ионный радиус среди элементов периодической системы. Ионный радиус щелочных металлов увеличивается от лития к цезию, что обусловлено увеличением числа электронных оболочек. Это свойство делает щелочные металлы очень реактивными и активными химическими элементами.
Щелочные металлы играют важную роль в различных сферах нашей жизни. Они используются в процессе производства стекла, щелочных батарей, синтеза органических соединений и прочих важных технологических процессах. Кроме того, серебристый блеск этих металлов делает их привлекательными для использования в ювелирных изделиях и декоративных изделиях.
Строение и свойства щелочных металлов
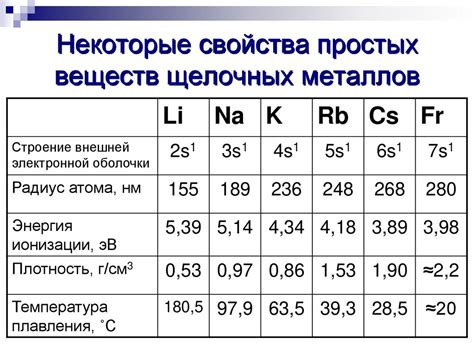
Щелочные металлы - это элементы группы I периодической системы. Они включают литий, натрий, калий, рубидий, цезий и франций. Строение атомов щелочных металлов представляет собой простую кубическую решетку. Атомный радиус щелочных металлов увеличивается по мере движения по группе снизу вверх.
Основные свойства щелочных металлов обусловлены наличием одного электрона в внешней энергетической оболочке. Именно этот электрон отвечает за высокую реактивность щелочных металлов. Они легко вступают в реакции со многими веществами, в том числе с водой и кислородом.
Вода вызывает живая химическая реакция с щелочными металлами. При этом образуется гидроксид щелочного металла и выделяется водород. Реакция очень энергичная, часто сопровождается выделением тепла и возгоранием водорода.
Щелочные металлы обладают высокой электропроводностью, поэтому они широко используются в электротехнике. Они также используются как основные компоненты в производстве растворимых солей, щелочей, средств пищевой промышленности и стеклянного и керамического производства.
Реакции щелочных металлов с водой и кислотами
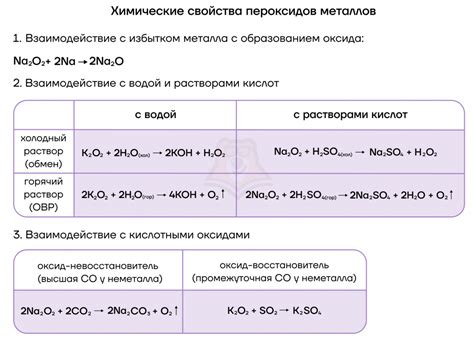
Реакции щелочных металлов с водой:
Щелочные металлы (литий, натрий, калий, рубидий и цезий) обладают высокой активностью и активно взаимодействуют с водой. При этом происходит образование гидроксида щелочного металла и выделение водорода.
Уравнение реакции щелочного металла (М) с водой (Н₂О):
2М + 2Н₂О → 2МОН + Н₂
Реакции щелочных металлов с кислотами:
Щелочные металлы также активно реагируют с кислотами, образуя соли и высвобождая водород. Реакция идет аналогично реакции с водой, только вместо воды вступает кислота.
Уравнение реакции щелочного металла (М) с кислотой (HCl):
2М + 2HCl → 2МCl + Н₂
Полученные в результате реакции соли могут быть использованы в различных сферах промышленности и жизни человека.
Таким образом, реакции щелочных металлов с водой и кислотами являются примером химических превращений, при которых активные щелочные металлы образуют соединения и выделяют газы.
Применение щелочных металлов в промышленности

Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, широко применяются в различных отраслях промышленности благодаря своим уникальным химическим свойствам.
Литий используется в производстве легких и прочных литий-ионных аккумуляторов, которые широко применяются в мобильных телефонах, ноутбуках и электромобилях. Также литий применяется в производстве стекла, керамики и лекарственных препаратов.
Натрий является одним из основных компонентов пищевых добавок и используется в производстве морской соли. Он также применяется в металлургии, производстве щелочей, стекла и мыла.
Калий служит важным элементом в сельском хозяйстве. Он используется как удобрение для повышения урожайности сельскохозяйственных культур. Калий также применяется в производстве стекла, мыловарении, производстве взрывчатых веществ.
Рубидий в основном применяется в оптической промышленности, например, в качестве материала для создания лазеров и фоточувствительных элементов. Он также используется в электронике, ядерной энергетике и химическом анализе.
Цезий применяется в ядерной энергетике, производстве атомных часов и исследовательских лабораториях. Он также находит применение в медицине, косметологии и производстве фоточувствительных элементов.
Таким образом, щелочные металлы играют важную роль в промышленности, обеспечивая производство различных продуктов и материалов, а также применяясь в высокотехнологичных областях, таких как электроника и ядерная энергетика.
Способы получения и хранения щелочных металлов

Щелочные металлы – это группа элементов периодической таблицы, включающая литий (Li), натрий (Na), калий (K), рубидий (Rb) и цезий (Cs). Они обладают высокой реакционной способностью и широко применяются в различных областях науки и промышленности.
Существуют различные способы получения щелочных металлов. Один из них – электролиз. В этом методе применяются специальные электролиты, которые содержат растворы соответствующих кислот или солей. Под действием постоянного тока происходит электрохимический разложение электролита и выделение щелочного металла.
Другой способ получения щелочных металлов – редукция. В этом случае металл получают путем взаимодействия соответствующего оксида или галогенида щелочного металла с редуцирующим веществом, например, углеродом или водородом.
Хранение щелочных металлов необходимо проводить с особым вниманием, так как они очень реакционны и могут взрываться при контакте с водой или воздухом. Для хранения используются специальные контейнеры из нержавеющей стали или стекла, которые предохраняют металлы от воздействия влаги и воздуха.
Дополнительно к контейнерам, могут использоваться вещества, которые поглощают влагу и реагенты, такие как силикагель или парафин. Эти материалы обеспечивают дополнительное сохранение щелочных металлов, предотвращая их окисление и образование гидроксидов при длительном хранении.
Важно помнить, что работа с щелочными металлами требует строгой соблюдения мер безопасности. Необходимо использовать специальные защитные средства, такие как перчатки и очки, а также проводить работу в специально оборудованных помещениях, обеспечивающих вентиляцию и возможность быстрого эвакуирования в случае аварийной ситуации.
Щелочные металлы и окружающая среда
Щелочные металлы - это группа химических элементов, которые имеют ряд важных применений в промышленности и технологии. Однако, их взаимодействие с окружающей средой также имеет значительное значение. Эти элементы обладают высокой химической активностью и могут вступать в реакции с различными веществами, в том числе с водой, воздухом и почвой.
К примеру, щелочные металлы активно реагируют с водой, образуя щелочь и выделяя водород. Это явление может оказывать влияние на экосистемы водоемов. Кроме того, выделение водорода при таких реакциях может представлять опасность в сфере безопасности.
Еще одним важным аспектом взаимодействия щелочных металлов с окружающей средой является их способность к реакции с воздухом. При этом образуются оксиды, которые могут образовывать агрессивные растворы воды и повреждать металлоконструкции. Такие реакции особенно важны для промышленных процессов и инженерных систем.
Также стоит отметить, что щелочные металлы могут влиять на химический состав почвы. Неконтролируемое попадание этих элементов в почву может привести к снижению плодородия и ухудшению условий для растений. В связи с этим, необходимо принимать меры по контролю выбросов и утилизации отходов, содержащих щелочные металлы.
Таким образом, взаимодействие щелочных металлов с окружающей средой имеет негативные последствия, которые могут быть как экологическими, так и техническими. Необходимо разрабатывать и внедрять меры контроля и предотвращения данных реакций, а также улучшать методы утилизации отходов для минимизации воздействия щелочных металлов на окружающую среду.
Значение щелочных металлов в жизни человека

Щелочные металлы - это группа элементов, которые имеют высокую активность и располагаются в первой группе периодической таблицы. Несмотря на свою реактивность, они играют важную роль в жизни человека и находят широкое применение в различных отраслях промышленности.
В нашей жизни потребность в щелочных металлах огромна. Натрий является основным компонентом поваренной соли, без которой невозможно представить нашу кухню. Калий необходим для нормального функционирования многих органов и систем организма, в том числе сердечно-сосудистой и нервной систем. Литий используется в фармакологии для производства препаратов, которые помогают при психических заболеваниях.
Щелочные металлы также широко применяются в промышленности. Натрий используется для производства мыла, стекла, щелочных батарей, сплавов и литья. Калий применяется в производстве удобрений, взрывчатых веществ, красителей и стекла. Рубидий и цезий используются в оптической и электронной промышленности, а также в науке при исследованиях межатомных связей.
Ценность щелочных металлов в жизни человека неоспорима. Их применение в разных областях делает их незаменимыми и востребованными элементами.
Вопрос-ответ

Какие важные свойства имеют щелочные металлы?
Щелочные металлы обладают рядом важных свойств: высокой реакционной способностью, мягкостью, низкой плотностью, низкой температурой плавления и кипения.
Какие элементы являются щелочными металлами?
К щелочным металлам относятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Почему щелочные металлы являются наиболее реакционноспособными?
Щелочные металлы имеют наибольшую активность, так как они легко отдают внешний (невалентный) электрон, образуя ион с положительным зарядом. Это связано с низкой ионизационной энергией внешнего электрона и большим радиусом атома, что упрощает процесс отдачи электрона.
На что влияет положение щелочных металлов в периодической системе?
Положение щелочных металлов в периодической системе влияет на их химические свойства. Как правило, свойства щелочных металлов усиливаются с увеличением номера группы (колонки) слева направо и с увеличением атомного номера внутри группы (снизу вверх).
