Электронная формула является важным инструментом в химии для обозначения расположения электронов в атомах и ионов. Каждый элемент имеет свою уникальную электронную формулу, которая указывает на количество электронов в каждом из энергетических уровней.
Когда атом металла образует ион с двумя положительными зарядами, электронная формула этого катиона будет отображать его электронную конфигурацию и потерю двух электронов. Например, для катиона кальция Ca2+ один из возможных вариантов электронной формулы будет:
1s2 2s2 2p6 3s2 3p6
Это означает, что в атоме кальция имеется 20 электронов, и они распределены по энергетическим уровням следующим образом: 2 электрона на первом уровне, 8 электронов на втором уровне и 8 электронов на третьем уровне. Когда кальций образует ион, он теряет два электрона с третьего уровня, чтобы достичь электронной конфигурации аргонового атома (2s2 2p6).
Электронная формула двухзарядного катиона металла помогает ученым и студентам лучше понять и объяснить химические реакции и соединения, а также предсказывать свойства и взаимодействия различных веществ.
Как определить электронную формулу?
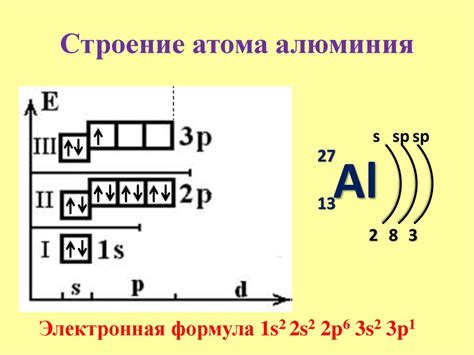
Электронная формула двухзарядного катиона металла позволяет определить расположение и количество электронов в его внешней электронной оболочке. Это важная информация для понимания химических свойств элементов и их возможности образовывать связи с другими атомами.
Определить электронную формулу можно, исходя из заряда катиона и его положения в периодической системе. Для двухзарядного катиона металла нужно учесть, что он потерял два электрона. Например, для катиона Fe2+ известно, что исходный атом железа имел 26 электронов. Потеря двух электронов приводит к тому, что в электронной формуле катиона Fe2+ будет указано только 24 электрона.
Упрощенно электронная формула двухзарядного катиона металла может быть представлена следующим образом:
- Указывается символ элемента, например Fe для железа.
- Далее указывается количество электронов в внешней электронной оболочке, учитывая потерю двух электронов. Например, для Fe2+ электронная формула будет Fe2+: 24 электрона.
Таким образом, зная заряд катиона и его исходное количество электронов, можно определить электронную формулу двухзарядного катиона металла. Эта информация важна для изучения свойств элементов и понимания их взаимодействия с другими веществами.
Особенности двухзарядного катиона
Двухзарядный катион – это ион металла, имеющий два положительных элементарных заряда. Такой катион образуется в результате потери двух электронов металлом в процессе окисления. Особенностью двухзарядного катиона является его высокая электрическая валентность, которая определяется его зарядом. Это позволяет двухзарядному катиону образовывать стабильные соединения с отрицательно заряженными анионами.
Примером двухзарядного катиона является ион железа Fe²⁺. Данный ион обладает двумя положительными зарядами и часто встречается в соединениях, таких как железо(II) оксид (FeO) или железо(II) сульфат (FeSO₄).
Двухзарядный катион имеет большую массу по сравнению с однозарядными катионами, так как его заряд вдвое превышает заряд однозарядного катиона. Это может сказываться на физических и химических свойствах соединений, содержащих двухзарядные катионы.
Важно отметить, что двухзарядный катион способен формировать и показывать различные степени окисления. Это означает, что металл в таком катионе может иметь несколько различных степеней окисления, в зависимости от условий реакции.
Как записать электронную формулу?

Электронная формула двухзарядного катиона металла позволяет описать распределение электронов в его электронных оболочках. Для записи электронной формулы необходимо учитывать заряд катиона, количество электронов в его валентной оболочке, а также правила заполнения электронных уровней.
Прежде всего, для записи электронной формулы нужно указать заряд катиона, обозначив его в виде верхнего индекса справа от химического символа. Например, для иона железа Fe2+ или Fe3+.
Далее, необходимо указать количество электронов в валентной оболочке катиона. Для этого можно использовать упорядоченное или неупорядоченное представление электронов на электронных уровнях. Например, для железа Fe2+ запись электронной формулы может выглядеть следующим образом: [Ar] 3d6. Здесь [Ar] означает, что электронная конфигурация катиона идентична электронной конфигурации аргона.
Правила заполнения электронных уровней также могут помочь в записи электронной формулы. Согласно правилу Хунда, электроны заполняют сначала энергетически более низкие уровни, а затем переходят на более высокие уровни. Важно помнить, что каждый электронный уровень может содержать только определенное количество электронов.
Таким образом, для записи электронной формулы двухзарядного катиона металла необходимо указать его заряд, количество электронов в валентной оболочке, а также следовать правилам заполнения электронных уровней. Это позволяет получить полное представление о распределении электронов в катионе и более глубокое понимание его химических свойств и поведения.
Значение электронной формулы

Электронная формула двухзарядного катиона металла является важным инструментом для описания и представления электронного строения атома этого металла. Электронная формула отображает расположение и количество электронов в каждой энергетической оболочке атома металла.
Зная электронную формулу двухзарядного катиона металла, можно определить количество электронов на каждой оболочке, а следовательно, и электронную конфигурацию атома. Это позволяет представить пространственное распределение электронов и понять, как атом участвует в химических реакциях и взаимодействии с другими атомами.
Электронная формула также помогает определить основные свойства металла, такие как его химическая активность, способность к образованию соединений, электропроводность и многие другие. Зная электронную формулу, мы можем сделать выводы о валентности данного металла и его способности образовывать ионы с различными зарядами.
Кроме того, электронная формула двухзарядного катиона металла может быть использована для построения энергетического уровня атома, позволяя анализировать и предсказывать его поведение в различных условиях. Она помогает в понимании особенностей электронной структуры металла и его реакционной способности.
Примеры двухзарядных катионов металлов

Жесткий двухзарядный катион:
Один из примеров двухзарядных катионов металлов - это катион Fe2+. Он образуется при потере двух электронов атомом железа (Fe), что приводит к образованию положительно заряженного иона с зарядом 2+. Этот катион имеет валентность 2, что означает, что атом железа способен образовать две химические связи с другими атомами или ионами.
Мягкий двухзарядный катион:
Другой пример двухзарядных катионов металлов - это катион Zn2+. Атом цинка (Zn) теряет два электрона, чтобы образовать положительно заряженный ион с зарядом 2+. Валентность этого катиона также равна 2, что делает цинк активным химическим элементом, способным образовывать две химические связи.
Переходный двухзарядный катион:
Один из примеров переходных металлов, образующих двухзарядный катион, - медь (Cu). Катион Cu2+ образуется, когда атом меди теряет два электрона. Этот ион обладает валентностью 2 и проявляет характерные катионные свойства, такие как способность образовывать ионные соединения с анионами и другими катионами.
Двухзарядный катион переходного периода таблицы Менделеева:
Один из самых известных двухзарядных катионов из группы переходных элементов - это катион железа Fe2+. Он широко используется в различных химических реакциях и в качестве катализатора. Катион Fe2+ имеет способность образовывать соединения с различными анионами и катионами, что делает его важным в области химии и материаловедения.
Заключение:
Примеры двухзарядных катионов металлов демонстрируют разнообразие их химических свойств и способность образовывать соединения с различными анионами и катионами. Это важно для понимания и применения электронной формулы двухзарядных катионов металлов в различных химических исследованиях и промышленных процессах.
Применение электронной формулы

Электронная формула двухзарядного катиона металла является важным инструментом в химических исследованиях, а также в технологических процессах промышленности. С ее помощью можно проводить анализ состава вещества, определять его структуру и свойства.
Основным преимуществом электронной формулы является возможность точного определения количества электронов, находящихся на внешнем энергетическом уровне атома. Это позволяет понять, какие химические реакции может совершать данный катион, а также оценить его реакционную способность.
Кроме того, электронная формула помогает предсказать возможные соединения катиона с другими элементами. Зная количество электронов на внешнем уровне, можно определить, какие атомы могут участвовать в образовании химической связи с данным катионом и какого типа будет эта связь.
Также электронная формула позволяет определить заряд катиона и его валентность. Зная эти параметры, можно определить, какие ионы связываются с данным катионом и в каких пропорциях, что имеет значение при составлении химических уравнений и вычислении массовых отношений в реакциях.
В промышленности электронная формула применяется при разработке новых материалов и легировании металлов. Она позволяет предсказать, какие элементы добавить в сплав, чтобы улучшить его свойства или придать ему определенные характеристики.
В целом, электронная формула двухзарядного катиона металла является удобным инструментом для исследования и практического применения в химической и промышленной сфере. Она помогает расширить наши знания о веществах и улучшить производственные процессы.
Вопрос-ответ

Какая электронная формула двухзарядного катиона металла?
Электронная формула двухзарядного катиона металла состоит из обозначения металла и указания его заряда, например, Fe2+ для двухзарядного иона железа или Cu2+ для двухзарядного иона меди.
Какие катионы металлов могут иметь два заряда?
Химические элементы, которые могут образовывать двухзарядные катионы, включают железо (Fe), медь (Cu), кобальт (Co), цинк (Zn), марганец (Mn) и некоторые другие.
Какая связь между электронной формулой и зарядом катиона металла?
Электронная формула показывает, какие именно электроны были потеряны металлом при образовании иона. Заряд катиона указывает, сколько электронов было потеряно, и в такой формуле заряд обычно указывается в верхнем индексе справа от химического символа металла.
