Металлы являются одной из наиболее распространенных групп веществ, которые обладают высокой химической активностью. Известно, что металлы образуют ионы с положительным зарядом и активно реагируют с различными веществами.
Основные правила, определяющие химическую активность металлов, основаны на их строении и электрохимических свойствах. Одним из основных правил является правило обмена, которое гласит, что металл может вытеснить из раствора своего иона металл с более низкой степенью активности. Это объясняется тем, что металл с более высокой степенью активности имеет большую способность отдавать электроны и образовывать положительные ионы.
Еще одним важным правилом является правило более активного металла, которое гласит, что более активный металл может вытеснить из своего соединения менее активный металл. Это правило базируется на электрическом потенциале металлов - чем он выше, тем более активным считается металл. Так, например, калий более активен, чем натрий, поэтому он может вытеснить натрий из его соединений.
Важно отметить, что правила, описывающие химическую активность металлов, могут изменяться в зависимости от условий реакции и наличия других веществ. Также стоит учитывать, что эти правила являются обобщенными и не всегда могут быть применимы к конкретным ситуациям.
В заключение, следует отметить, что химическая активность металлов играет важную роль во многих процессах, в том числе в химической промышленности и в технологических процессах. Знание основных правил, описывающих химическую активность металлов, позволяет лучше понять и предсказывать химические реакции, связанные с металлами, а также применять их в различных областях науки и техники.
Металлы и их активность

Металлы являются основным классом химических элементов, обладающих высокой теплопроводностью, электропроводностью и пластичностью. Их активность определяется способностью образовывать ионные соединения с неметаллами. Активность металлов может быть выражена их реакционной способностью.
Основным правилом, описывающим химическую активность металлов, является ряд напряжения металлов. В данном ряду металлы расположены по возрастанию их активности, причеми на одном конце находятся самые активные металлы, а на другом - наименее активные.
Самые активные металлы обладают высокой реакционной способностью и активно вступают во взаимодействие с водой, кислотами и галогенами. Примерами таких металлов явлюятся калий, натрий и кальций.
Металлы средней активности также образуют соединения с водой и кислотами, но уже не так активно, как самые активные металлы. Примером металлов средней активности являются магний, цинк и алюминий.
Наименее активные металлы мало реактивны и образуют соединения только с сильными окислителями, такими как хлор, кислород или фтор. Примерами наименее активных металлов являются медь, серебро и золото.
Что такое химическая активность металлов?

Химическая активность металлов – это способность металлов участвовать в химических реакциях и образовании соединений с другими веществами. Активность металлов определяется их положением в электрохимическом ряду, где металлы располагаются в порядке убывания их восстановительной способности.
Наиболее активные металлы находятся в верхних позициях электрохимического ряда и легко вступают в реакции с кислородом, водой и различными химическими соединениями. Они обладают высокой способностью отдавать электроны и образовывать положительные ионы.
Металлы средней активности, такие как железо и цинк, имеют более слабую способность вступать в химические реакции. Они могут образовывать несколько типов положительных ионов и реагировать с некоторыми кислотами и основаниями.
Наименее активные металлы находятся в нижней части электрохимического ряда. Они обладают слабой способностью участвовать в химических реакциях и образовывать соединения. Часто они находятся в свободном состоянии в природе в виде слитков или руды и не реагируют с окружающими веществами без дополнительного воздействия.
Основные факторы, влияющие на активность металлов

Активность металлов зависит от нескольких факторов, которые определяют способность металла вступать в химические реакции и образование соединений. Одним из ключевых факторов является электроотрицательность металла, которая определяет его склонность к отдаче электронов.
Также важным фактором является ионизационная энергия металла, то есть энергия, необходимая для отрыва электрона от атома. Металлы с низкой ионизационной энергией обладают высокой активностью, так как они легко отдают электроны и образуют положительные ионы.
Другим важным фактором является размер атома металла. Большие металлы с малым числом электронов во внешнем энергетическом уровне имеют большую активность. Это связано с тем, что электроны находятся на большем расстоянии от ядра и слабо удерживаются электростатическим притяжением.
Также влияние на активность металлов оказывает их позиция в ряду активности. Металлы, находящиеся выше в ряду, более активны и более легко вступают в реакции. Например, натрий и калий более активны, чем медь и железо.
Кроме того, влияние на активность металлов может оказывать их степень окисления. Металлы с низкой степенью окисления, такие как натрий и магний, активно вступают в реакции, в то время как металлы с высокой степенью окисления, такие как алюминий и железо, менее активны.
Свойства, определяющие активность металлов

Активность металлов определяется рядом факторов и свойств, которые влияют на их химическую способность вступать в реакции с другими веществами. Некоторые из основных свойств, определяющих активность металлов:
- Электроотрицательность: Металлы с более низкой электроотрицательностью обладают более высокой активностью. Электроотрицательность указывает на склонность атомов металлов принимать или отдавать электроны при реакциях.
- Энергия ионизации: Энергия, необходимая для удаления электрона из атома металла, является показателем его активности. Чем ниже энергия ионизации, тем более активный металл.
- Размер атома: Маленькие атомы имеют большую активность, поскольку их электроны слабее удерживаются ядром и легче участвуют в реакциях.
- Плотность электронов: Металлы с большей плотностью электронов в своей внешней оболочке обладают более высокой активностью, поскольку их электроны легче отдавать.
- Способность образовывать ионы: Металлы, способные образовывать положительные ионы более легко, обычно являются более активными металлами.
Эти свойства металлов взаимодействуют друг с другом и определяют их активность. Чем больше химических реакций может провести металл, тем более активным он считается. Понимание этих свойств позволяет установить порядок активности металлов и использовать эту информацию в химических процессах и реакциях.
Взаимодействие металлов с другими веществами
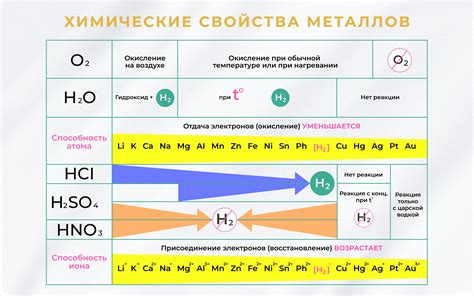
Металлы вступают во взаимодействие с различными веществами, образуя соединения и проявляя различную химическую активность. Известно, что металлы реагируют с кислотами, основаниями, солями и другими веществами.
Взаимодействие металлов с кислотами может происходить с образованием солей и выделением водорода. Например, железо реагирует с соляной кислотой, образуя хлорид железа и выделяя водород. Взаимодействие металлов с основаниями также приводит к образованию солей, например, натрий реагирует с гидроксидом калия, образуя гидроксид натрия и выделяя газ.
С некоторыми веществами металлы вступают в реакцию только при нагревании. Например, алюминий реагирует с кислотным оксидом серы, образуя соль и выделяя газ диоксид серы при нагревании. Взаимодействие металлов с солями может привести к образованию более активных металлов в ряду с активностью, так называемому "переносу металла".
Взаимодействие металлов с другими веществами может также происходить при электрическом взаимодействии. При подключении металлического элемента к электрическому источнику тока происходит электролиз, в результате которого на металле проявляется активность и изменяется цвет. Например, при электролизе раствора серной кислоты на аноде происходит окисление металла, а на катоде — восстановление, что приводит к изменению состояния металла и сопровождается химическими реакциями.
Практическое применение знания об активности металлов

Знание об активности металлов имеет важное практическое применение в различных областях науки и производства. Например, оно необходимо при выборе материалов для создания коррозионностойких конструкций.
Металлы с высокой активностью, такие как натрий или калий, не рекомендуется использовать в окружающей среде, содержащей влагу или кислород, так как они быстро реагируют с водой или влажным воздухом, приводя к образованию коррозионных продуктов. Вместо этого предпочтительнее выбирать металлы с низкой активностью, такие как нержавеющая сталь или алюминий, которые обладают большей устойчивостью к коррозии.
Знание об активности металлов также является основой для определения возможности проведения электрохимических реакций. Например, при выборе анодного материала для гальванического покрытия, необходимо учитывать разность потенциалов между материалами. Металл с более высокой активностью будет служить анодом и вступать в реакцию с окружающей средой, оставляя меньше возможностей для коррозии материала с меньшей активностью.
Правильный выбор материалов на основе знания об активности металлов также важен при разработке батарей и аккумуляторов. Металлы с высокой активностью, такие как литий или калий, обладают высокой электрохимической активностью и могут эффективно использоваться в качестве электродов. С другой стороны, металлы с низкой активностью, такие как свинец или цинк, могут быть использованы в качестве анодов для защиты других металлов от коррозии.
Вопрос-ответ

Какие основные правила описывают химическую активность металлов?
В химии существует несколько основных правил, которые описывают химическую активность металлов. Одно из таких правил - это ряд металлов, который отражает их способность участвовать в реакциях с кислотами. В этом ряду металлы расположены по убыванию активности: от самых активных, таких как щелочные металлы (натрий, калий) до наиболее пассивных металлов, таких как платина и золото.
Какие факторы влияют на химическую активность металлов?
Химическая активность металлов зависит от нескольких факторов. Во-первых, она зависит от электрохимического потенциала металла. Чем ниже потенциал металла, тем он более активен и более легко вступает в реакции. Во-вторых, активность металлов может быть также определена их способностью участвовать в реакциях с кислотами и основаниями. И наконец, активность металлов может быть повышена или понижена в зависимости от окружающей среды, в которой они находятся. Например, некоторые металлы могут быть более активными в кислых условиях, а другие - вкислотных или щелочных условиях.
