Одной из основных тем химии является изучение взаимодействия атомов и молекул. Особый интерес представляет изучение связи, которая возникает при взаимодействии атомов металлов. Металлы обладают уникальными свойствами, которые определяются их внутренней структурой и способностью образовывать связи.
Связь между атомами металлов основана на обмене электронами. Металлическая связь характеризуется тем, что электроны образуют общий облако, которое окружает положительно заряженные ядра атомов. Такая связь позволяет металлам обладать хорошей электропроводностью, теплопроводностью и эластичностью.
Возникновение металлической связи связано с особенностями электронной структуры атомов металлов. Внешний энергетический уровень металлов содержит свободные электроны, которые легко перемещаются между атомами. При взаимодействии атомов металлов эти свободные электроны образуют электронное облако, которое является основным фактором удерживающим атомы металлов в кристаллической решетке.
Рождение связи возникает

Связь между атомами металлов формируется на основе взаимодействия их электронных облаков. При приближении атомов создается электростатическое взаимодействие между их зарядами, что снижает энергию системы. Это приводит к образованию связи, которая имеет энергетический минимум - связывающую длину и связывающую энергию.
Связь между атомами металлов характеризуется высокой электропроводностью и теплопроводностью. Атомы металлов имеют небольшое количество валентных электронов, которые могут свободно передвигаться и образовывать межатомные связи.
Рождение связи между атомами металлов происходит при наличии достаточной энергии для преодоления барьеров, препятствующих их взаимодействию. Энергия может быть предоставлена в результате нагревания, механического давления или воздействия других факторов.
Атомы металлов, образующие связь, стремятся достичь более устойчивого состояния, в котором их электронные облака сильно взаимодействуют и образуют общую область, называемую "море электронов". Это облегчает передачу заряда и свободное движение электронов, что обуславливает электропроводность металлов.
При взаимодействии атомов металлов

Взаимодействие атомов металлов определяет особенности их структуры и химических свойств. Металлы обладают способностью образовывать кристаллическую решетку, в которой атомы металла занимают определенные позиции.
При взаимодействии атомов металлов происходит обмен электронами. Атомы металла отдают свои внешние электроны и становятся положительно заряженными ионами - катионами. Эти катионы образуют положительное ядро металла и обуславливают его металлические свойства.
В атомных решетках металлов между катионами образуются связи, называемые металлическими связями. Они являются необычными, так как в них предполагается наличие общих электронов, которые перемещаются по всей решетке, образуя электронное облако.
Металлические связи обеспечивают высокую электропроводность, теплопроводность, пластичность и другие характеристики металлов. Электронное облако, называемое электронами свободного движения, способствует передаче электрического тока и тепла, а также формированию металлического блеска и способности металлов быть прочными и гибкими.
Опосредованное взаимодействие
Опосредованное взаимодействие - это процесс образования связи между атомами металлов, при котором взаимодействующие атомы не контактируют прямо, а через промежуточное вещество или другие атомы, которые формируют связь между ними.
Химические реакции, основанные на опосредованном взаимодействии атомов металлов, происходят под влиянием различных факторов, таких как температура и концентрация реагентов, давление и наличие катализаторов. В результате таких реакций образуются комплексы, в которых атомы металлов связаны друг с другом.
Примером опосредованного взаимодействия может служить реакция образования солей металлов. При взаимодействии металла с кислотой происходит образование соли и выделение водорода. В данном случае промежуточным веществом является кислота, которая активирует металл и позволяет ему образовать связь с другими атомами металла.
Опосредованное взаимодействие используется в различных процессах, включая электролиз, каталитические реакции и синтез новых веществ. Изучение этого типа взаимодействия атомов металлов позволяет лучше понять основы химии и применить полученные знания в различных областях науки и технологий.
Важная роль электронов

При взаимодействии атомов металлов играют важную роль их электроны. Электроны являются негативно заряженными частицами, находящимися вокруг ядра атома. Они образуют электронное облако, которое окружает ядро. При взаимодействии двух атомов металлов, электроны из внешней оболочки одного атома переходят на внешнюю оболочку другого атома.
Перенос электронов позволяет образоваться связи между атомами металлов. Электроны, перейдя на внешнюю оболочку другого атома, становятся общими для обоих атомов. Это явление называется обменной связью. Обмен электронами позволяет создать стабильные области, называемые ионными решетками или кристаллическими решетками.
Обменные связи между атомами металлов обеспечивают силу взаимодействия и создают определенную структуру вещества. Именно благодаря этим связям, металлы обладают своими особыми свойствами, такими как электропроводность и теплопроводность.
Межмолекулярное взаимодействие
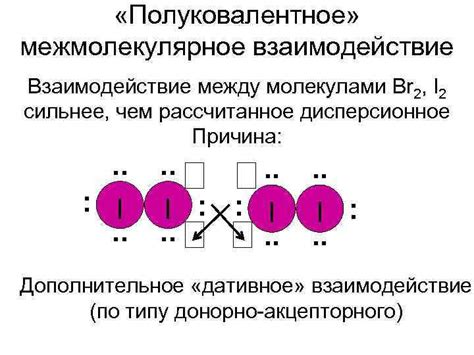
Межмолекулярное взаимодействие – это явление, при котором атомы или молекулы вступают во взаимодействие друг с другом. Данное явление играет ключевую роль в различных химических процессах и определяет свойства вещества.
Существует несколько типов межмолекулярного взаимодействия. Одним из них является ван-дер-Ваальсово взаимодействие, которое проявляется между нейтральными атомами или молекулами. Оно обусловлено изменением электронной плотности вокруг атомов или молекул при их приближении или удалении друг от друга. В результате возникают слабые притягивающие или отталкивающие силы.
Еще одним типом межмолекулярного взаимодействия является электростатическое взаимодействие. Оно возникает из-за различия в заряде между разными атомами или молекулами. Атомы или молекулы с положительным зарядом притягиваются к атомам или молекулам с отрицательным зарядом и наоборот.
Межмолекулярное взаимодействие имеет решающее значение для формирования химических связей и структуры вещества. Оно определяет физические и химические свойства веществ, такие как температура плавления или кипения, твердотельные структуры и растворимость в различных средах.
Взаимодействие через электронные облака
Металлы обладают особенным строением атомов, что обуславливает их способность образовывать связи между собой. При взаимодействии атомов металлов связь формируется через электронные облака, которые охватывают металлические атомы.
В электронных облаках металлов электроны располагаются свободно и не привязаны к конкретным атомам. Они образуют так называемую "электронную оболочку", которая окружает положительно заряженное ядро атома. Благодаря этому свободному движению электроны могут передвигаться от одного атома к другому в металлической сетке.
Взаимодействие через электронные облака происходит посредством обмена электронами между атомами. При этом возникает общая "электронная область". Она создает электрический положительный заряд, привлекательно воздействующий на электроны и вызывающий их движение от одного атома к другому.
Электроны при взаимодействии через электронные облака формируют "металлическую связь". Это особая форма связи, которая обладает рядом уникальных свойств. Металлическая связь обеспечивает прочность и эластичность металла, его электропроводность и теплопроводность.
Вопрос-ответ

Что такое связь при взаимодействии атомов металлов?
Связь при взаимодействии атомов металлов - это сила, которая удерживает атомы металлов вместе и образует металлическую структуру. Она возникает благодаря электронам, которые свободно двигаются по металлической решетке, создавая силовое поле, которое притягивает атомы металлов друг к другу.
Как возникает связь при взаимодействии атомов металлов?
Связь при взаимодействии атомов металлов возникает за счет обмена и перемещения электронов между атомами. Атомы металлов обладают слабым удержанием своих электронов внутри оболочек, и эти электроны могут свободно перемещаться между атомами. При этом образуется общая оболочка электронов, которая формирует металлическую связь и обеспечивает структуру металла.
Какие факторы влияют на силу связи при взаимодействии атомов металлов?
Сила связи при взаимодействии атомов металлов зависит от нескольких факторов. Во-первых, она зависит от типа металла. Некоторые металлы имеют более сильную связь, так как их атомы обладают большей электроотрицательностью или большим числом электронов. Во-вторых, сила связи зависит от расстояния между атомами. Чем ближе атомы, тем сильнее связь. И, наконец, сила связи зависит от числа электронов, участвующих в образовании связи. Чем больше электронов, тем сильнее связь.
