Одной из основных характеристик атома металла является число электронов, которые атом может отдать. Это число определяется положением элемента в периодической системе и степенью окисления атома. В процессе химической реакции металл может потерять один или несколько электронов из внешней электронной оболочки. Это связано с высоким энергетическим уровнем этих электронов и их готовностью к отдаче.
Количество отдаваемых электронов зависит от валентности металла. Валентность - это число, показывающее, сколько электронов атом металла может отдать или приобрести в процессе химической реакции. Чем выше валентность металла, тем больше электронов он может отдать.
Также число отдаваемых электронов может зависеть от того, с какими атомами металл вступает в химическую реакцию. Некоторые металлы могут отдать разное количество электронов в зависимости от того, какой элемент находится в окружении. Это связано с тем, что разные атомы обладают разной электроотрицательностью, что влияет на силу притяжения между ними и атомами металла.
Наиболее ярким примером является железо, которое встречается в двух существенно различных окислительных состояниях: двухвалентное (Fe2+) и трехвалентное (Fe3+). В двухвалентном состоянии железо отдаёт два электрона, в трехвалентном - три электрона.
Таким образом, число электронов, отдаваемых атомом металла, является важным характеристикой, влияющей на его химические свойства и способность вступать в реакции с другими веществами.
Число электронов в атоме металла и его значение

Число электронов в атоме металла определяется его атомным номером, который соответствует числу протонов в ядре атома. В данных атомах также присутствуют и нейтроны, однако их число не влияет на количество электронов.
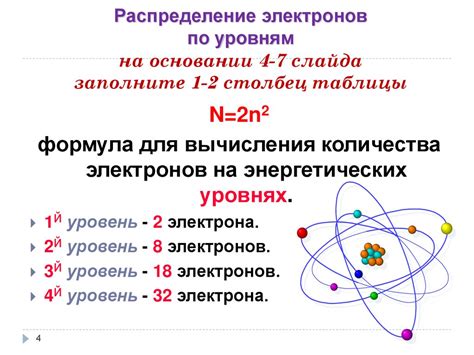
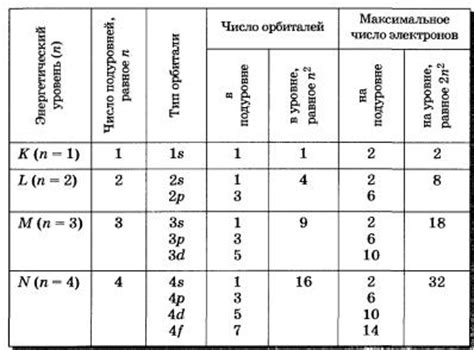
Количество электронов в атоме металла играет важную роль в его химических свойствах. Электроны находятся в энергетических уровнях, или оболочках, которые описываются квантовыми числами. Общая структура уровней электронов в атоме металла может быть представлена в виде электронной конфигурации.
Электроны в атомах металлов имеют тенденцию формировать ионные связи с другими атомами, отдавая лишние электроны или принимая дополнительные. Число электронов, отдаваемых атомом металла, зависит от его валентности, то есть от количества электронов во внешней энергетической оболочке. Это число имеет большое значение при определении свойств и химической активности металла.
Определение числа электронов в атоме металла является важным шагом в изучении его структуры и свойств. Изучение электронной структуры металла позволяет предсказывать его реакционную способность и использовать его в различных технических приложениях. Количество электронов в атоме металла является фундаментальной характеристикой, определяющей его химические и физические свойства.
Роль электронов в атоме металла
Электроны играют важную роль в атоме металла и в определении его химических, электрических и физических свойств. Благодаря своей подвижности и относительно низкому энергетическому уровню, электроны металла обладают уникальными свойствами.
Первое и наиболее важное свойство электронов металла - их способность передвигаться внутри атомной структуры. Это объясняет хорошую проводимость электричества и тепла у металлов. Свободные электроны металла могут легко перемещаться между атомами, создавая электрический ток или перенося тепло.
Кроме того, электроны металла являются важными игроками в химических реакциях. Они участвуют в процессе образования химических связей и определяют степень взаимодействия атомов металла с другими элементами или соединениями. Более высокая или более низкая энергия электронов может изменить свойства металла, такие как термическая или химическая стабильность.
Стоит отметить, что количество электронов, отдаваемых атомом металла, может быть разным и зависит от его положения в периодической таблице. Например, щелочные металлы, такие как литий или натрий, легко отдают один электрон, образуя ион с положительным зарядом. Другие металлы, например железо или медь, имеют более сложную электронную конфигурацию и отдают разное количество электронов в зависимости от условий реакции.
В целом, электроны в атоме металла играют решающую роль в определении его химических, электрических и физических свойств. Их подвижность и участие в химических реакциях делают металлы особенно ценными материалами в различных областях науки и промышленности.
Основные факторы, влияющие на число отдаваемых электронов

Число электронов, отдаваемых атомом металла, зависит от нескольких факторов. Одним из важных факторов является валентность металла. Валентность определяет, сколько электронов может атом отдать или принять при образовании химических связей. Чем выше валентность металла, тем больше электронов он способен отдать.
Другим фактором, влияющим на число отдаваемых электронов, является электроотрицательность атома металла. Электроотрицательность характеризует способность атома притягивать электроны. Чем ниже электроотрицательность металла, тем больше электронов он готов отдать при образовании химических связей.
Кроме того, число отдаваемых электронов может зависеть от структуры кристаллической решетки металла. В кристаллической решетке металла атомы последовательно расположены, и каждый атом имеет своих соседей. Влияние соседних атомов может сказаться на способности атома отдавать электроны. Например, если атом окружен атомами с более высокой электроотрицательностью, он может удерживать свои электроны сильнее и отдавать их меньше.
Еще одним важным фактором является наличие внешней оболочки атома металла, которая содержит свободные или полудоступные электроны. Степень заполненности внешней оболочки влияет на число отдаваемых электронов. Чем меньше электронов в внешней оболочке, тем больше электронов атом готов отдать.
В итоге, число отдаваемых электронов атомом металла зависит от его валентности, электроотрицательности, структуры кристаллической решетки и степени заполненности внешней оболочки. Знание этих факторов позволяет более точно предсказывать химические свойства и реактивность металла.
Эффект окислительности и электроотрицательность

Эффект окислительности атомов металла определяется их способностью отдавать электроны при взаимодействии с другими веществами. Чем больше атом металла теряет электронов, тем большую окислительную способность он обладает. Окислительные свойства металлов зависят от электроотрицательности, которая характеризует их способность привлекать электроны.
Электроотрицательность является химической величиной, которая выражает относительную способность атома притягивать электроны в химической связи. Атомы с высокой электроотрицательностью имеют большую способность притягивать электроны и, соответственно, проявляют окислительные свойства.
На основе электроотрицательности атомов металлов можно составить таблицу, называемую рядом электроотрицательности. В этой таблице элементы располагаются в порядке возрастания электроотрицательности. Чем выше стоит элемент в ряду, тем сильнее он проявляет электроотрицательность и окислительные свойства. Электроотрицательность помогает определить, какие атомы металла способны отдать электроны, а какие атомы неметалла могут принять электроны и образовать с ними ионные связи.
Таким образом, эффект окислительности атомов металла и их электроотрицательность тесно связаны и определяют химические свойства металлов при взаимодействии с другими веществами. Это позволяет объяснить, почему некоторые металлы более активны в химических реакциях и способны образовывать соединения с различными элементами.
Связь между отдаваемыми электронами и химическими свойствами металлов

Химические свойства металлов, в основном, определяются числом электронов, которые атомы металла могут отдать. Это число, также известное как валентность, играет важную роль в формировании связей между атомами и, следовательно, в определении различных химических свойств металлов.
Большинство металлов имеют небольшую электроотрицательность и, следовательно, могут легко отдавать свои электроны другим элементам. Число отдаваемых электронов зависит от внешней электронной конфигурации атома металла. Например, валентность металлов из группы 1 (щелочные металлы) равна 1, так как они имеют один электрон в своей внешней оболочке и готовы отдать его другим элементам.
Число отдаваемых электронов также влияет на способность металлов образовывать ионы положительного заряда. Чем больше электронов атом может отдать, тем выше его валентность и тем больше положительного заряда он может приобрести при образовании иона. Это важно при образовании химических соединений, так как ионы металлов с положительным зарядом играют важную роль в реакциях.
Однако, не все металлы могут отдать все свои электроны. За исключением щелочных и щелочноземельных металлов, большинство металлов имеют валентность, меньшую, чем их общее число электронов во внешней оболочке. Это связано с тем, что отдавать все электроны может быть энергетически не выгодно для атома.
Таким образом, связь между отдаваемыми электронами и химическими свойствами металлов состоит в том, что число отдаваемых электронов определяет их валентность, способность образовывать ионы положительного заряда и участвовать в химических реакциях. Это важный фактор, который определяет различные свойства и поведение металлов в химических соединениях.
Применение знаний о числе отдаваемых электронов в химии и технике
Знание о числе электронов, отдаваемых атомом металла, имеет важное значение в химии и технике. Эти сведения позволяют нам понять, как металлы могут образовывать ионы и как они могут вступать в химические реакции.
В химии, число отдаваемых электронов является ключевым понятием при изучении реакций между металлами и другими веществами. Оно определяет, насколько легко или трудно атом металла может быть окислен или восстановлен в химической реакции. Эта информация позволяет химикам контролировать реакции и создавать новые вещества с нужными свойствами.
В технике, знание о числе отдаваемых электронов помогает в разработке и создании различных материалов. Например, металлы с большим числом отдаваемых электронов могут быть использованы в качестве проводников электричества, так как они легко передают электроны. Некоторые металлы, в которых электроны слабо отдаются, могут быть использованы для создания защитных покрытий и покрытий от коррозии.
Также, знание о числе отдаваемых электронов играет роль в создании электронных устройств, таких как транзисторы. Транзисторы изготавливаются из полупроводников, который имеют особое количество отдаваемых электронов. Это позволяет контролировать поток электронов и создавать логические операции, используемые в электронной технике и компьютерах.
Следовательно, понимание числа отдаваемых электронов является важным инструментом при проведении химических реакций и создании новых материалов и технологий. Эти знания помогают улучшать производительность и качество различных процессов и изделий.
Вопрос-ответ

Какой атомный радиус влияет на количество отданных электронов?
Количество отданных электронов зависит от эффективного атомного радиуса металла. В общем случае, чем больше атомный радиус, тем больше электронов может атом отдать.
Существует ли какая-то закономерность в отношении металлов и количества отданных электронов?
Да, существует. Большинство металлов имеют свойство отдавать электроны и образовывать положительные ионы. Количество отданных электронов зависит от энергии ионизации, которая определяет, насколько легко атом может отдать электрон.
Может ли атом металла отдать все свои электроны?
В теории атом металла может отдать все свои электроны и образовать положительный ион. Однако на практике, в большинстве случаев, металлы отдают только некоторое количество электронов, образуя положительный ион с определенной зарядностью.
Как можно определить количество отданных электронов атомом металла?
Количество отданных электронов атомом металла можно определить по его тривиальной зарядности. Например, если атом металла образует ион с зарядом +2, то это означает, что он отдал два электрона.
