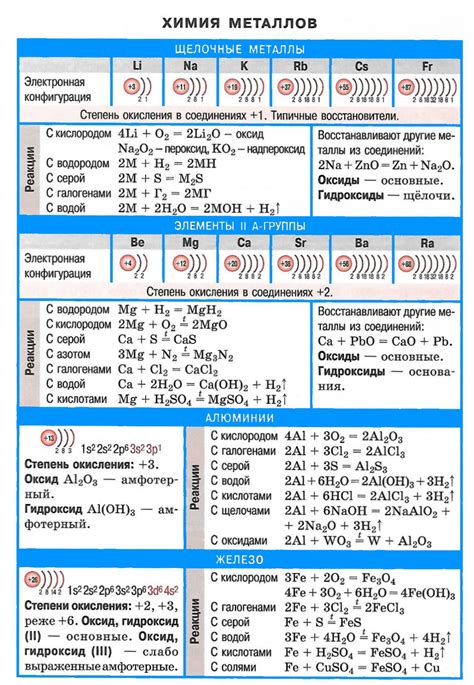
Щелочные металлы - это класс элементов периодической таблицы, включающий в себя литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они являются самыми активными металлами и обладают рядом уникальных химических свойств.
Одной из ключевых характеристик щелочных металлов является их способность реагировать с водой. Когда щелочные металлы помещают в воду, они образуют гидроксиды и высвобождаются водород. Например, реакция натрия с водой выглядит следующим образом:
2Na + 2H2O -> 2NaOH + H2
Другим важным свойством щелочных металлов является их способность образовывать соли. Они реагируют с кислотами, образуя металлические соли. Например, реакция калия с хлороводородной кислотой приведет к образованию хлорида калия:
K + HCl -> KCl + H2
Также щелочные металлы обладают высокой электроотрицательностью и активностью. Они способны легко окисляться и реагировать с кислородом, нитрогеном и другими элементами. Благодаря своей активности, щелочные металлы широко применяются в различных областях, включая производство сплавов, батареек и испытаний на установления состава веществ.
Химические свойства щелочных металлов: их важность в нашей жизни
Щелочные металлы - это группа элементов, включающая литий, натрий, калий, рубидий, цезий и франций. Они широко применяются в различных областях нашей жизни благодаря своим специфическим химическим свойствам.
Во-первых, щелочные металлы обладают высокой активностью и реакционной способностью. Они легко реагируют с водой, выделяя водород и образуя гидроксиды, что делает их необходимыми в процессах электролиза и производстве водорода.
Во-вторых, щелочные металлы используются в качестве катализаторов в различных химических реакциях. Натрий и калий, например, широко применяются в фармацевтической и пищевой промышленности для синтеза различных органических соединений.
В-третьих, щелочные металлы, особенно калий, имеют важное значение в биологических системах. Они являются неотъемлемыми элементами в составе клеток и играют важную роль в поддержании водно-солевого баланса и нервно-мышечной активности.
В-четвертых, щелочные металлы применяются в технике и энергетике. Например, литий широко используется в производстве литиевых аккумуляторов, которые являются основой многих портативных электронных устройств.
В целом, химические свойства щелочных металлов играют важную роль в нашей жизни, они помогают нам решать различные технические, биологические и промышленные задачи, делают нашу жизнь комфортнее и безопаснее.
Активность щелочных металлов: значительное влияние на реактивность
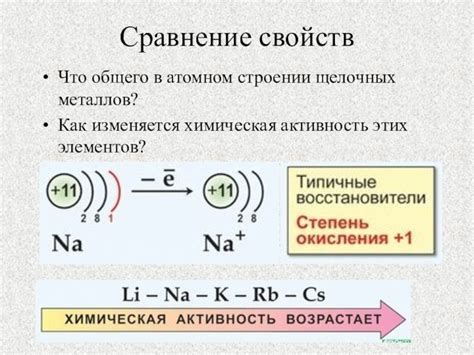
Щелочные металлы отличаются высокой активностью и входят в первую группу таблицы Д.И. Менделеева. Их реактивность определяется электрохимическими свойствами, такими как способность отдавать электроны и образование ионов с положительным зарядом.
Наивысшей активностью обладает литий, который является самым малораспространенным щелочным металлом. Литий легко реагирует с кислородом, водой и галогенами, образуя оксиды, гидроксиды и соли. Калий и натрий, следующие за литием в ряду щелочных металлов, также являются очень активными и реагируют с водой, выделяя водород.
Активность щелочных металлов проявляется также в их способности образовывать соединения с различными элементами. Например, соединения натрия, калия и других щелочных металлов широко используются в различных отраслях промышленности, медицине и быту. Они служат основными компонентами в производстве стекла, мыле, удобрений, лекарств и т.д.
Таким образом, активность щелочных металлов играет важную роль в их реактивности и способности образовывать различные химические соединения. Эти элементы являются неотъемлемой частью нашей повседневной жизни и имеют широкое применение в различных сферах деятельности человека.
Восстановительные свойства щелочных металлов: незаменимые вещества в промышленности
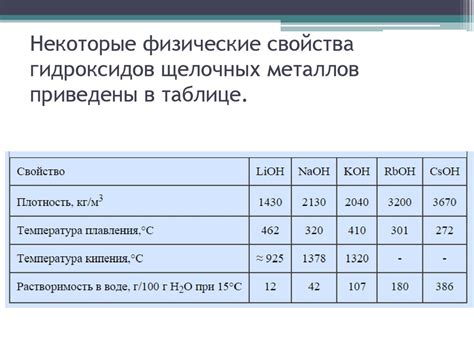
Щелочные металлы, такие как литий, натрий, калий и другие, обладают высокой активностью и уникальными восстановительными свойствами, что делает их незаменимыми веществами в промышленности.
Одним из наиболее важных применений щелочных металлов является их использование в процессе электролиза. Например, натрий и калий широко применяются в производстве алюминия методом электролиза, что позволяет снизить энергозатраты и повысить эффективность процесса. Кроме того, щелочные металлы используются в производстве других металлов и сплавов.
Второе важное применение щелочных металлов связано с их способностью взаимодействовать с водой и образовывать щелочные растворы. Натрий и калий широко применяются в химической промышленности для получения щелочей, которые используются в производстве мыла, стекла, бумаги и других продуктов.
Кроме того, щелочные металлы играют важную роль в радиационной промышленности. В связи с высокой аффинностью к радиоактивным элементам, они применяются для очистки отходов, а также в процессе синтеза и разделения радиоактивных веществ.
Таким образом, восстановительные свойства щелочных металлов делают их незаменимыми веществами в промышленности. Они находят широкое применение в электролизе, производстве щелочей, радиационной промышленности и других областях. Кроме того, щелочные металлы являются важными компонентами в различных химических реакциях и синтезах, способствуя развитию инновационных технологий и улучшению качества жизни.
Реакция щелочных металлов с кислородом: основа огнетушителей
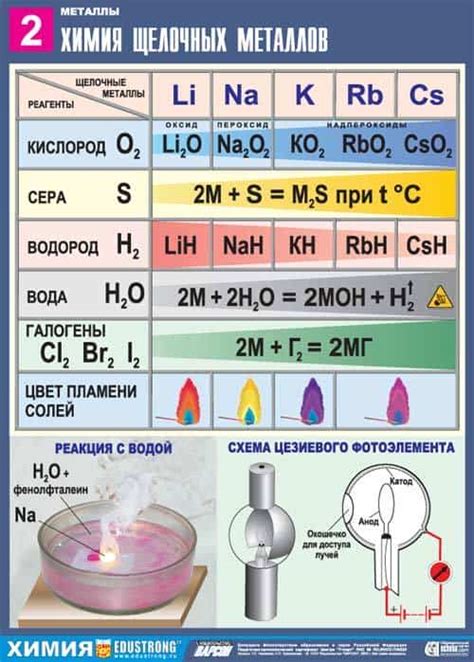
Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, проявляют высокую реакционную способность с кислородом, что делает их важными компонентами огнетушителей. Реакция этих металлов с кислородом происходит при попадании воздуха в огненное очаги и сопровождается выделением тепла и света.
Когда щелочный металл взаимодействует с кислородом, образуются щелочные оксиды. Например, реакция натрия с кислородом приводит к образованию натрия оксида (Na2O). Эти соединения обладают резким щелочным характером и являются эффективными огнетушителями, так как проявляют высокую активность взаимодействия с веществами, за счет чего прекращают горение.
Применение щелочных металлов в огнетушителях обусловлено их реакционной способностью и способностью нейтрализовать окислители. Кроме того, они обладают высоким распространением в огне благодаря быстрому растворению оксида металла в воде, что способствует охлаждению огненного очага.
Итак, реакция щелочных металлов с кислородом играет важную роль в области пожаротушения, обеспечивая безопасность и защиту от пожаров. Они активно применяются в огнетушителях и позволяют эффективно бороться с возгораниями различных классов.
Вопрос-ответ

Какие свойства характерны для щелочных металлов?
Щелочные металлы характеризуются такими свойствами, как низкая плотность, низкая температура плавления, хорошая электропроводность и химическая активность.
Какие соединения образуют щелочные металлы с другими элементами?
Щелочные металлы образуют соединения с большинством других элементов, в том числе с кислородом, серой, халогенами и некоторыми металлами. Например, натрий может образовывать соединения с кислородом (натриевый оксид), серой (натриевая сульфид) и хлором (натриевый хлорид).
Чем обусловлена химическая активность щелочных металлов?
Химическая активность щелочных металлов обусловлена их низкой ионизационной энергией и большим радиусом ионов. Ионизационная энергия указывает на силу, с которой электрон удерживается в электронной оболочке атома. Чем ниже ионизационная энергия, тем легче отделить электрон и тем более активным в химических реакциях будет металл.
