Степень окисления - это числовое значение, которое показывает количество электронов, передаваемых металлом при образовании ионов соответствующей окислительной способности. В химии эта характеристика является одной из ключевых, так как она позволяет определить химические свойства и реакционную активность металлов. Для основных подгрупп металлов существует ряд правил, по которым можно определить степени окисления.
В основные подгруппы относятся щелочные металлы и щелочноземельные металлы, которые расположены в первых двух группах периодической системы. Щелочные металлы (литий, натрий, калий и др.) имеют степень окисления +1, так как они наиболее активны и отдают один электрон при образовании положительно заряженных ионов. Щелочноземельные металлы (магний, кальций, стронций и др.) имеют степень окисления +2, поскольку они отдают два электрона при образовании ионов.
Знание степени окисления металлов основных подгрупп позволяет определить и предсказать их химическую активность, способность образовывать соединения и участвовать в реакциях. Это особенно важно в органической химии, где реакции с участием металлов являются важным элементом синтеза и превращения органических соединений. Таким образом, изучение степени окисления металлов основных подгрупп играет ключевую роль в понимании и применении химических процессов.
Степень окисления и металлы

Степень окисления является характеристикой химического состояния металла, которая описывает, сколько электронов металл способен потерять или получить в химических реакциях.
В основных подгруппах периодической системы расположены металлы, имеющие различные степени окисления. Например, вторая группа металлов (щелочноземельные) имеет степень окисления +2, что означает, что эти металлы способны потерять два электрона. Это включает металлы такие как магний (Mg), кальций (Ca), стронций (Sr) и барий (Ba).
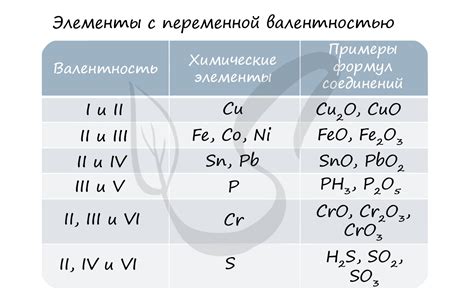
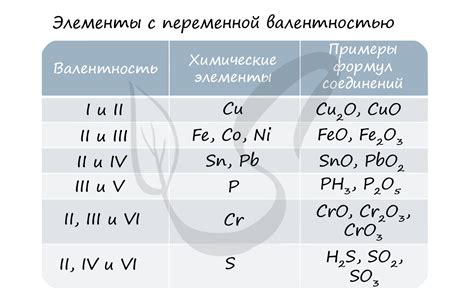
Третья группа металлов (переходные) имеет различные степени окисления, которые могут варьироваться от +2 до +7. Например, марганец (Mn) способен иметь степень окисления +2, +4 или +7 в различных соединениях.
Некоторые металлы имеют не только положительные степени окисления, но и отрицательные. Например, железо (Fe) может иметь степень окисления +2 или +3, а также -2. Это значит, что железо может как отдавать, так и принимать электроны в различных реакциях.
Способность металлов менять свою степень окисления позволяет им образовывать различные соединения и участвовать в разнообразных реакциях. Знание о степени окисления металлов позволяет установить и предсказать их поведение в химических реакциях, что важно для многих областей науки и технологий.
Общие принципы степени окисления

Степень окисления (или валентность) - это числовое значение, показывающее, сколько электронов отдает или принимает атом при образовании химической связи или при участии в реакции. Для металлов основных подгрупп можно выделить несколько общих принципов определения степени окисления.
1. Нулевая степень окисления: В некоторых случаях, металлы могут иметь степень окисления равную нулю. Например, в элементарном состоянии атом натрия имеет нулевую степень окисления.
2. Степень окисления равна заряду катиона: В многих неорганических соединениях, степень окисления металла равна заряду катиона. Например, в соединении AlCl3, алюминий имеет степень окисления +3, так как образует катион Al3+.
3. Сумма степеней окисления в молекуле равна нулю: В нейтральной молекуле сумма степеней окисления всех атомов должна быть равна нулю. Например, в молекуле водорода (H2), каждый атом водорода имеет степень окисления +1, чтобы сумма степеней окисления была равна нулю.
4. Степень окисления кислорода в соединении равна -2: В большинстве соединений кислорода его степень окисления равна -2. Например, в воде (H2O), кислород имеет степень окисления -2.
5. Степень окисления водорода в соединении равна +1: В большинстве соединений водорода его степень окисления равна +1. Например, в металлогидридах, таких как NaH, степень окисления водорода равна +1.
Учитывая эти общие принципы, можно определить степень окисления для металлов основных подгрупп и выполнять химические расчеты и анализы.
Степень окисления для первой подгруппы металлов

Степень окисления для первой подгруппы металлов может быть различной в зависимости от условий их окружения. Однако существуют основные степени окисления, которые характерны для данной группы.
Первая подгруппа металлов включает такие элементы, как литий, натрий, калий, рубидий и цезий. Основная характеристика этих металлов - наличие одного электрона на внешней энергетической оболочке.
Степень окисления для этих элементов обычно равна +1. Это происходит из-за того, что обмен электронами между элементами первой подгруппы и другими элементами происходит таким образом, что металлы отдают свой внешний электрон. Такое отдача электрона приводит к положительной степени окисления.
Примеры оксидов первой подгруппы металлов с указанием соответствующей степени окисления:
- Литий (Li) - оксид Li2O, степень окисления +1.
- Натрий (Na) - оксид Na2O, степень окисления +1.
- Калий (K) - оксид K2O, степень окисления +1.
- Рубидий (Rb) - оксид Rb2O, степень окисления +1.
- Цезий (Cs) - оксид Cs2O, степень окисления +1.
Таким образом, все металлы первой подгруппы имеют степень окисления +1, что является характерной особенностью данной группы металлов.
Степень окисления для второй подгруппы металлов
Вторая подгруппа металлов включает металлы, у которых наиболее распространенная степень окисления равна +2.
В эту подгруппу входят металлы, такие как цинк, кадмий и марганец. У этих металлов нарушена заполненность внешней оболочки электронами, и они образуют ионы, имеющие два положительных заряда.
Цинк — металл серебристо-синего цвета, который часто используется в промышленности и строительстве. Элементарный цинк имеет электронную конфигурацию [Ar] 3d10 4s2, и когда он окисляется, теряет два электрона, образуя ионы Zn2+, со степенью окисления +2.
Кадмий — тяжелый металл, который широко используется в производстве аккумуляторов, пигментов и сплавов. У кадмия электронная конфигурация [Kr] 4d10 5s2, и он образует ионы Cd2+, имеющие степень окисления +2.
Марганец — серебристо-серый металл, который находит применение в производстве стали и других металлических сплавов. У марганца электронная конфигурация [Ar] 3d5 4s2, и он образует ионы Mn2+ с положительным зарядом +2.
Степень окисления играет важную роль в химических реакциях и определяет способность металлов образовывать соединения с другими веществами. Знание степени окисления помогает в изучении свойств металлов и их применении в различных отраслях промышленности.
Степень окисления для третьей подгруппы металлов
Третья подгруппа металлов включает в себя элементы группы 3 периодической системы, такие как скандий, иттрий, лантан и их редкие земли. Степень окисления для металлов третьей подгруппы может быть различной и зависит от условий и химической реакции, в которой они участвуют.
Одним из наиболее распространенных состояний окисления для металлов третьей подгруппы является +3. Например, иттрий (Y) имеет степень окисления +3, а также редкоземельные элементы, такие как церий (Ce), прометий (Pm) и все последующие элементы в этой серии.
Однако некоторые элементы третьей подгруппы также могут иметь более высокие степени окисления. Например, лантан (La) может иметь степень окисления +3 и +4. Это связано с его электронной конфигурацией и возможностью потери электронов из внешней оболочки.
Другим интересным аспектом степени окисления для металлов третьей подгруппы является их способность образовывать соединения с отрицательными степенями окисления. Например, иттрий может образовать соединения, в которых его степень окисления составляет -3.
В целом, степень окисления для металлов третьей подгруппы может быть разнообразной и зависит от их химических свойств и условий реакции. Эти элементы имеют важное значение в различных отраслях промышленности и научных исследованиях.
Вопрос-ответ

Какова степень окисления для металлов основных подгрупп?
Степень окисления для металлов основных подгрупп может быть разной и зависит от конкретного металла. Например, для щелочных металлов (натрия, калия и др.) степень окисления обычно составляет +1, а для щелочноземельных металлов (магния, кальция и др.) - +2. Важно отметить, что это значение может меняться в зависимости от условий реакции.
Какие металлы относятся к основным подгруппам?
К основным подгруппам относятся щелочные металлы и щелочноземельные металлы. К щелочным металлам относятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Щелочноземельные металлы включают бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Эти металлы имеют схожие свойства и часто используются в различных промышленных процессах.
Как можно определить степень окисления для металлов основных подгрупп?
Определение степени окисления для металлов основных подгрупп можно осуществить, исходя из их валентности (число электронов во внешней оболочке). Например, щелочные металлы имеют один электрон во внешней оболочке и, следовательно, имеют степень окисления +1. Щелочноземельные металлы имеют два электрона во внешней оболочке и обычно имеют степень окисления +2. Однако, в некоторых случаях, степень окисления может быть и другой и зависит от условий реакции.
Как степень окисления влияет на свойства металлов основных подгрупп?
Степень окисления влияет на свойства металлов основных подгрупп, определяя их реакционную активность и способность вступать в химические реакции. Металлы с низкой степенью окисления, например, щелочные металлы со степенью окисления +1, обладают высокой реакционной активностью и легко образуют положительные ионы. Металлы с более высокой степенью окисления, как щелочноземельные металлы со степенью окисления +2, обладают менее высокой реакционной активностью. Это свойство имеет значение при взаимодействии этих металлов с другими веществами и определяет их возможности в химических реакциях.
