Водород – это самый легкий элемент в таблице Менделеева, и его химические свойства обычно связывают с его высокой реактивностью. Однако, существуют определенные металлы, которые не реагируют с водородом, образуя металлические гидриды. Это явление известно как нереактивность водорода с некоторыми металлами.
Одной из причин нереактивности водорода с определенными металлами является их высокая электроотрицательность. Электроотрицательность – это мера способности атома притягивать электроны к себе. Металлы с высокой электроотрицательностью имеют тенденцию образовывать ковалентные связи с водородом, образуя металлические гидриды. Однако, некоторые металлы имеют низкую электроотрицательность, что делает их нереактивными с водородом.
Кроме электроотрицательности, нереактивность водорода с некоторыми металлами может быть также связана с их структурой и химическими свойствами. Например, некоторые металлы имеют очень плотную кристаллическую решетку, что затрудняет проникновение молекул водорода в их структуру. Кроме того, некоторые металлы не обладают достаточной реакционной способностью, чтобы формировать связь с молекулами водорода.
Проблема нереактивности водорода

Водород является самым легким элементом в периодической системе элементов, и его химические свойства определяются его простотой и структурой атома. Однако, несмотря на свою простоту, водород оказывается нереактивным с большинством металлов.
Проблема нереактивности водорода с металлами состоит в том, что водород не проникает в кристаллическую решетку металлических материалов и не взаимодействует с их атомами. При этом водород обладает высокой мобильностью и способен проникать в через поры и трещины в металле, а также растворяться в металлической матрице. Однако, такое проникновение водорода в металлы не приводит к химическому взаимодействию, поэтому водород остается нереактивным.
Проблема нереактивности водорода с металлами имеет большое значение в различных областях, таких как энергетика, химическая промышленность, электроника и другие. Водород может использоваться в качестве альтернативного источника энергии, однако его нереактивность с металлами затрудняет его использование в этих областях.
Чтобы решить проблему нереактивности водорода с металлами, проводятся исследования по разработке специальных материалов и катализаторов, которые способны активировать водород и обеспечивать его взаимодействие с металлами. Такие материалы обладают специальной структурой и химическим составом, которые позволяют активировать водород и создавать реакционные пути для его взаимодействия с металлами.
Роль металлов в реакции

Металлы играют важную роль в реакции с водородом, так как именно они обладают способностью взаимодействовать с водородом при определенных условиях. Это связано с особенностями строения и свойств металлической решетки, а также химической активностью этих элементов.
В процессе реакции металлы могут адсорбировать молекулы водорода на своей поверхности. Данное взаимодействие может происходить при повышенных температурах или при наличии катализаторов. После адсорбции водорода на поверхности металла, могут происходить различные физические и химические изменения, включая проникновение атомов водорода в кристаллическую решетку металла.
В результате взаимодействия металлов с водородом могут образовываться металлогидриды. Это соединения, в которых водород находится в качестве отрицательно заряженного аниона H-. Металлогидриды обладают различными свойствами, которые определяются как химическими свойствами металла, так и свойствами связанного с ним атома водорода.
Также стоит отметить, что не все металлы способны реагировать с водородом. Некоторые металлы, такие как золото или платина, обладают низкой активностью и поэтому не взаимодействуют с водородом при обычных условиях. Однако, с помощью специальных катализаторов или при повышенных температурах можно достичь реакции этих металлов с водородом.
Нереактивность водорода с железом
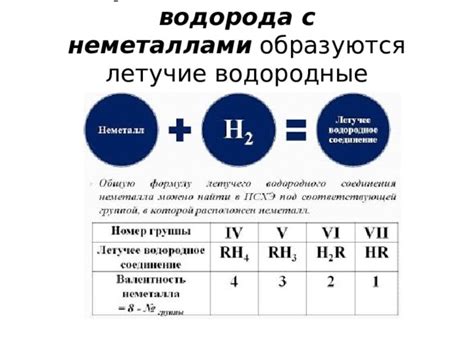
Железо – один из самых распространенных металлов в природе, и его нереактивность с водородом является важным свойством для различных процессов и приложений. Водород, будучи химическим элементом с планетарным распространением, имеет способность образовывать соединения с металлами. Однако, в случае с железом, нереактивность становится заметной.
Нереактивность железа с водородом связана с его физическим и химическим строением. Железо обладает крепкой кристаллической решеткой, что делает его стабильным и малореактивным в большинстве условий. Также, железо образует пассивную оксидную пленку на своей поверхности, что подавляет реакцию с водородом.
Хотя в обычных условиях железо нереактивно с водородом, но в некоторых особых условиях может происходить процесс десорбции – выделение водорода из металла. Это может происходить при достаточно высоких температурах, при воздействии катализаторов или в присутствии растворителей.
Таким образом, нереактивность водорода с железом является важным свойством данного металла и может быть использована в различных отраслях промышленности и науке.
Влияние нереактивности на промышленность
Нереактивность водорода, особенно его отсутствие реакции с определенными металлами, играет значительную роль в промышленности. Реакция водорода с металлами может вызывать коррозию и разрушение материалов, поэтому нереактивность водорода с определенными металлами становится важной характеристикой для многих отраслей промышленности.
Прежде всего, нереактивность водорода с металлами имеет огромное значение в производстве контейнеров и трубопроводов. Если бы водород активно реагировал с металлами, это привело бы к быстрому износу и разрушению систем газопровода и трубопровода, а также вызвало бы утечки газа. Нереактивный характер водорода позволяет обеспечивать безопасность и надежность систем газоснабжения и транспортировки газа.
Кроме того, нереактивность водорода с определенными металлами играет важную роль в производстве электроники и приборов. Водород интенсивно используется в процессе производства полупроводников, и нереактивность водорода с определенными металлами позволяет обеспечить стабильность и долговечность приборов, а также защитить их от коррозии и разрушения.
Кроме того, нереактивность водорода с металлами играет роль в производстве легких сплавов и материалов. Водород является важным компонентом процессов спекания, легирования и гидровакуумного спекания, и нереактивность водорода позволяет получить качественные и прочные материалы, применяемые в авиации, автомобильной и судостроительной промышленности.
Нереактивность водорода с алюминием

Алюминий — легкий металл с атомным номером 13 в периодической системе элементов. При комнатной температуре алюминий образует оксидационную пленку на своей поверхности, которая предотвращает продолжительную реакцию с водой или кислородом из воздуха.
Нереактивность водорода с алюминием обусловлена этой оксидационной пленкой, которая стабилизирует поверхность металла и защищает его от дальнейшей окислительной реакции. Поэтому водород и алюминий не взаимодействуют друг с другом при обычных условиях.
Тем не менее, при достижении высоких температур алюминий может реагировать с водой при образовании алюминия гидроксида и выделения водорода. Также возможно взаимодействие алюминия с концентрированными кислотами или щелочами, но только при их нагревании или других специальных условиях.
Алюминий обладает высокой коррозионной стойкостью благодаря оксидационной пленке, поэтому часто используется в различных областях, включая строительство, авиацию, электронику и др. Тем не менее, при необходимости взаимодействия с водородом или другими веществами, требуется специальная обработка поверхности алюминия или использование специальных реагентов.
Возможные причины нереактивности

Существуют несколько возможных причин, по которым водород может быть нереактивен с определенными металлами:
Пассивация поверхности: Некоторые металлы обладают защитным слоем оксида или других соединений на своей поверхности, который препятствует взаимодействию с водородом. Этот слой может быть образован спонтанно в атмосферных условиях или сформироваться в результате пассивации металла при взаимодействии с другими веществами.
Высокая энергия связи: Некоторые металлы имеют очень сильные химические связи между атомами в кристаллической структуре, что затрудняет разрыв этих связей для образования соединений с водородом. Это может происходить из-за особенностей электронной структуры металла или его межатомных взаимодействий.
Электрохимическая инертность: Некоторые металлы могут обладать высокой электрохимической инертностью, что означает, что они мало взаимодействуют с другими веществами при применении электрического потенциала. Это может быть связано с особенностями электронной структуры или поверхностной активности металла.
Все эти факторы могут влиять на восприимчивость металлов к химическому взаимодействию с водородом и объяснять нереактивность некоторых систем.
Практические применения нереактивности водорода с определенными металлами

1. Водородное хранение: Нереактивность водорода с некоторыми металлами, такими как платина или нержавеющая сталь, позволяет использовать эти материалы для изготовления сосудов или резервуаров, предназначенных для хранения водорода. Это важно в различных областях, включая энергетику, где водород используется как источник энергии или средство хранения энергии для различных устройств.
2. Гидридные аккумуляторы: Некоторые сплавы металлов с водородом образуют гидриды, которые можно использовать в гидридных аккумуляторах. Эти аккумуляторы обладают высокой энергетической плотностью и широко применяются в различных устройствах, например, в электроавтомобилях. Нереактивность металла с водородом позволяет этим аккумуляторам быть стабильными и безопасными в использовании.
3. Катализаторы: Водород популярно используется как восстановитель во многих катализаторах. Нереактивность металлов с водородом позволяет им выполнять свою функцию катализатора без участия в химических реакциях, что делает их более эффективными и стабильными. Катализаторы могут быть использованы в различных отраслях, включая промышленность и производство.
4. Производство аммиака: Водород используется в процессе производства аммиака, который является одним из основных компонентов многих удобрений. Некоторые металлы, такие как железо или никель, absorb водород, что помогает в процессе формирования аммиака. Нереактивность металлов с водородом позволяет им быть надежными катализаторами в этом процессе.
Исследования и перспективы

Исследования в области нереактивности водорода с определенными металлами являются важным направлением в химии и материаловедении. За последние десятилетия было много проведено исследований, в результате которых были получены ценные данные о взаимодействии водорода с различными металлами.
Одним из интересных аспектов исследований является определение механизмов нереактивности водорода с металлами. Ученые обнаружили, что некоторые металлы, такие как золото и платина, практически не реагируют с водородом в нормальных условиях, в то время как другие металлы, например, железо и никель, могут образовывать химические соединения с водородом.
Перспективы исследований в этой области связаны с поиском новых материалов с улучшенными свойствами, такими как повышенная стойкость к воздействию водорода. Это особенно актуально в контексте разработки новых материалов для хранения и переноса водорода, которые могут быть использованы в технологиях водородной энергетики.
Одним из возможных направлений исследований является анализ электрохимических свойств металлов при взаимодействии с водородом. Ученые и инженеры ищут способы улучшения каталитической активности металлов в процессе электролиза воды или производства водорода из других источников.
Также существует потенциал в разработке новых композиционных материалов, включающих металлы и другие вещества, которые могут быть активными в процессе взаимодействия с водородом. Это может открыть новые возможности в области катализа водородных реакций и создания новых эффективных материалов для различных целей.
Вопрос-ответ

Почему водород не реагирует с некоторыми металлами?
Ответ: Водород не реагирует с некоторыми металлами из-за их низкой активности. Некоторые металлы имеют стабильную электронную конфигурацию, и их внешний слой электронов уже полностью заполнен, поэтому они не стремятся связывать дополнительные атомы водорода.
Какие металлы образуют соединения с водородом?
Ответ: С водородом образуют соединения металлы из группы I и II периодической системы, такие как литий, натрий и калий. Также реакцию с водородом могут образовывать металлы из группы III-VIII при определенных условиях, например, при высокой температуре или в присутствии катализаторов.
Почему некоторые металлы могут реагировать с водородом только при определенных условиях?
Ответ: Некоторые металлы могут реагировать с водородом только при определенных условиях, потому что эта реакция требует определенной энергии активации. Это может быть высокая температура, повышенное давление или наличие катализаторов. При таких условиях происходит активация металла и образование связи между атомами водорода и металла.
