Металлы - это вещества, обладающие рядом характерных особенностей, которые связаны с структурой атомов. Компоненты металлов имеют свои особенности, отличающие их от атомов других элементов. Основные особенности атомов металлов подтверждают их физические и химические свойства, такие, как теплопроводность, электропроводность, легкость обработки и т. д.
Первое, что отличает атомы металлов от атомов других элементов, это их электронное строение. Атомы металлов имеют относительно малое количество электронов на внешней оболочке, что делает их склонными к потере электронов и образованию положительного заряда. Это объясняет хорошую электропроводность металлов.
Вторым важным аспектом атомов металлов является их кристаллическая структура. Атомы металлов образуют решетку, где каждый атом находится на определенном расстоянии от соседних атомов. Это объясняет прочность и механические свойства металлов, такие как твердость и пластичность. Кристаллическая структура также обуславливает способность металлов к теплопроводности и электропроводности.
Также следует отметить, что атомы металлов могут образовывать сплавы, то есть смеси из нескольких металлов. Это возможно благодаря простоте взаимодействия атомов металлов между собой. Сплавы имеют свои уникальные свойства, которые могут быть использованы в различных областях, таких как производство инструментов, авиационная и космическая промышленность и др.
В целом, атомы металлов обладают рядом особенностей, которые отличают их от атомов других элементов. Электронное строение, кристаллическая структура и возможность образования сплавов являются основными особенностями, которые определяют физические и химические свойства металлов.
Определение и классификация
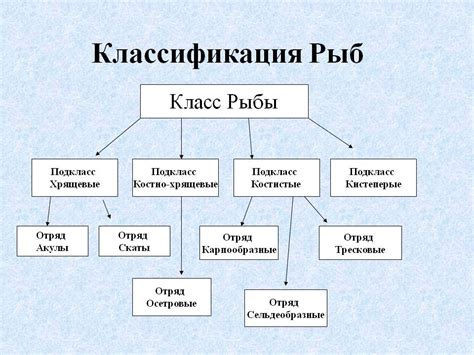
Атом - это основная единица химического элемента, состоящая из ядра, в котором находятся протоны и нейтроны, и электронной оболочки, включающей электроны.
Металлы - это класс элементов, обладающих определенными химическими и физическими характеристиками. Атомы металлов обладают особыми особенностями, которые делают их уникальными по сравнению с другими элементами.
Металлы обычно характеризуются малым количеством электронов во внешней оболочке, что влияет на их химическую активность и способность образовывать положительные ионы. Это приводит к тому, что металлы обычно обладают способностью проводить электричество и тепло, быть хорошими поглотителями и отражателями света.
Атомы металлов могут образовывать кристаллическую решетку, в которой атомы металлов располагаются в определенном порядке и образуют жесткую структуру. Это делает металлы прочными и твердыми в сравнении с другими элементами.
Некоторые металлы могут иметь различные кристаллические структуры или различные аллотропные формы, такие как железо, которое может быть в форме феррита, аустенита и цементита.
Также металлы могут быть классифицированы по своей химической реактивности. Некоторые металлы, такие как золото, серебро и платина, являются химически инертными, то есть они практически не взаимодействуют с другими веществами. В то же время, некоторые металлы, такие как натрий и калий, очень реактивны и могут легко реагировать с водой или кислородом.
Электронная структура атомов металлов
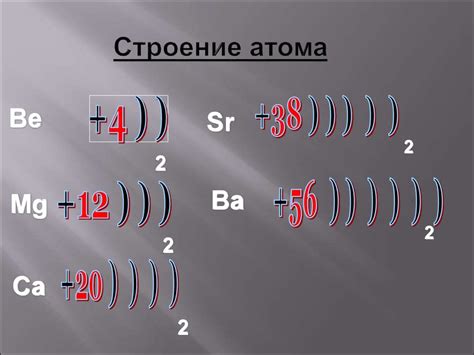
Атомы металлов обладают особенной электронной структурой, которая делает их основными источниками проводимости электричества и тепла. Эта структура обусловлена огромным количеством свободных электронов, которые способны легко двигаться по кристаллической решетке.
Основу электронной структуры атомов металлов составляет внешний энергетический уровень (валентная оболочка), на котором находятся свободные электроны. Они образуют так называемую "электронный облако", которое окружает ядро атома. Благодаря этому облаку, атомы металлов способны легко передавать электроны друг другу.
Каждый металл отличается своей электронной конфигурацией – расположением электронов на энергетических уровнях. Однако, в большинстве атомов металлов валентная оболочка содержит от одного до нескольких свободных электронов. Именно благодаря этим свободным электронам металлы проявляют свойства проводников электричества и тепла.
Электроны в атомах металлов находятся в постоянном движении, создавая так называемое "электронное облако". При воздействии электрического поля они легко переходят с одного атома на другой, что обеспечивает высокую электропроводность вещества. Кроме того, свободные электроны способны передавать тепло, что делает металлы отличными теплопроводниками.
Физические свойства атомов металлов

Атомы металлов обладают рядом особенных физических свойств, которые делают их уникальными в мире химии и физики. Во-первых, атомы металлов обладают высокой электроотрицательностью, что позволяет им легко образовывать ионные связи с другими атомами и молекулами.
Во-вторых, атомы металлов обладают большим количеством электронов на своей внешней энергетической оболочке, что обуславливает их способность к проведению электричества и тепла. Это свойство делает металлы ценными материалами в различных отраслях промышленности, таких как электротехника и металлургия.
Кроме того, атомы металлов обладают высокой плотностью и тяжестью, что делает их прочными и стойкими к деформации. Это позволяет использовать металлы для создания конструкций, предметов быта и других материалов, которые должны выдерживать большие нагрузки и сохранять свою форму.
И еще одно интересное свойство атомов металлов - их способность образовывать кристаллическую решетку. Это означает, что атомы металлов располагаются в определенном порядке, образуя устойчивую структуру, которая обладает определенными механическими, термическими и электрическими свойствами.
В целом, физические свойства атомов металлов отличаются от свойств атомов других элементов и являются основой для их использования в различных отраслях науки и промышленности.
Химические свойства атомов металлов

Атомы металлов обладают рядом уникальных химических свойств, которые отличают их от атомов неметаллов. Одной из основных характеристик металлических атомов является их низкая электроотрицательность. Это означает, что они имеют слабую способность притягивать электроны к себе и образовывать с ними ковалентные связи.
Металлические атомы также обладают способностью образовывать ионные связи. Это связано с тем, что у них малая энергия ионизации - энергия, необходимая для отрыва электрона от атома. Благодаря этой свойству металлы могут образовывать положительно заряженные ионы – катионы.
Еще одной важной характеристикой атомов металлов является их способность образовывать металлические связи. Это особый тип связи, при которой свободные электроны атомов металла образуют общую электронную оболочку, обеспечивая электронную подвижность в металлических кристаллах. Благодаря этому свойству металлы обладают высокой электропроводностью и теплопроводностью.
Также металлические атомы способны образовывать сплавы - смеси двух или более металлов, обладающие уникальными свойствами, отличными от свойств каждого из компонентов по отдельности. Это позволяет создавать различные сплавы с нужными химическими, физическими и механическими свойствами.
Реактивность атомов металлов

Реактивность атомов металлов является одной из ключевых особенностей, определяющих их химические свойства. Атомы металлов имеют склонность к взаимодействию с другими элементами, образуя разнообразные соединения.
Одной из причин высокой реактивности атомов металлов является их низкая ионизационная энергия. Ионизационная энергия определяет энергию, необходимую для удаления одного электрона из атома. У металлов эта энергия обычно достаточно низкая, что делает их атомы легко ионизируемыми.
Атомы металлов также обладают высокой электроотрицательностью, что делает их склонными к донорскому поведению. Они готовы отдавать электроны другим элементам, образуя положительно заряженные ионы (катионы). Это позволяет металлам проявлять реактивность при взаимодействии с различными соединениями и реагентами.
Степень реактивности атомов металлов может варьироваться в зависимости от их положения в периодической системе элементов. Например, щелочные металлы (натрий, калий и т.д.) являются очень реактивными и легко реагируют с водой и кислородом. В то же время, атомы переходных металлов (никель, железо и т.д.) обладают более умеренной реактивностью, что связано с их сложной электронной структурой.
Таким образом, реактивность атомов металлов играет важную роль в их химических свойствах. Она определяет способность металлов вступать в различные химические реакции и образовывать соединения с другими элементами. Это делает металлы важными компонентами множества промышленных и бытовых продуктов, а также способных налаживать химические реакции в организмах живых существ.
Применение атомов металлов

1. Использование атомов металлов в промышленности.
Атомы металлов широко применяются в различных отраслях промышленности. Они используются в производстве металлических изделий, таких как детали машин и оборудования, электроника, строительные конструкции и прочие изделия из металла. Атомы металлов обеспечивают прочность, термическую и электрическую проводимость, а также множество других важных свойств, которые необходимы в промышленных процессах.
2. Использование атомов металлов в электронике.
Атомы металлов являются важными компонентами многих электронных устройств. Их электрическая проводимость и способность к образованию стабильных связей с другими атомами позволяют создавать различные электронные компоненты, такие как провода, контакты, чипы и полупроводники. Атомы металлов также используются для создания различных электродов, аккумуляторов и источников питания.
3. Использование атомов металлов в медицине.
Атомы металлов играют важную роль в медицине и здравоохранении. Они используются для создания медицинских инструментов, имплантатов, протезов и других изделий, которые должны обладать высокой прочностью и биосовместимостью. Некоторые металлы, такие как золото и платина, также применяются в фармацевтике для создания лекарственных препаратов и применяются в радиотерапии для лечения опухолей.
4. Использование атомов металлов в энергетике.
Атомы металлов играют важную роль в производстве и хранении энергии. Например, атомы железа используются в производстве магнитов, которые используются в генераторах электроэнергии. Металлы также применяются в аккумуляторах и батареях для хранения электрической энергии. Атомы металлов также используются в солнечных панелях и других альтернативных источниках энергии.
5. Использование атомов металлов в научных исследованиях.
Атомы металлов широко используются в научных исследованиях для создания новых материалов и разработки новых технологий. Например, атомы металлов могут быть использованы для создания наночастиц, которые обладают уникальными свойствами и имеют широкий потенциал применения в различных областях, включая медицину, энергетику, электронику и катализаторы. Металлы также используются в различных физических и химических экспериментах для изучения и понимания основных законов природы.
Вопрос-ответ

Какие основные особенности атомов металлов?
Атомы металлов обладают несколькими особенностями. Во-первых, они имеют маленький радиус и большую электроотрицательность, что делает их хорошими проводниками электричества и тепла. Во-вторых, у атомов металлов обычно много свободных электронов, что позволяет им образовывать ионные связи с другими атомами. Кроме того, атомы металлов имеют обычно малое количество энергетических уровней, что результирует в устойчивых конфигурациях их электронной оболочки.
Почему атомы металлов являются хорошими проводниками электричества и тепла?
Атомы металлов обладают свободными электронами, которые могут свободно двигаться по кристаллической решетке металла. При наличии электрического поля эти электроны начинают двигаться в определенном направлении, создавая электрический ток. Аналогично, свободные электроны могут переносить тепло, передавая его другим атомам металла через столкновения. Именно благодаря свободным электронам атомы металлов обладают высокой электропроводностью и теплопроводностью.
