Основания – это вещества, способные отдавать ионы гидроксида (ОН-) или других отрицательных групп. Процесс, при котором основание отделяет эти ионы в растворе, называется диссоциацией оснований. В результате диссоциации образуются анионы металлов, что делает основания важными реагентами в химических реакциях.
Диссоциация оснований происходит благодаря ионному характеру связи между металлом и гидроксидной группой. Когда основание попадает в воду или другую растворяющую среду, связь между металлом и гидроксидом разрывается, а ионы разделяются. Анионы металлов имеют отрицательный заряд и играют важную роль во многих химических реакциях и процессах.
Важно отметить, что каждое основание имеет уникальные свойства диссоциации. Некоторые основания диссоциируют полностью, то есть все вводимые молекулы разлагаются на ионы. Другие основания диссоциируют лишь частично, то есть только некоторая часть молекул разлагается на ионы. Факторы, влияющие на диссоциацию оснований, включают концентрацию раствора, pH среды и температуру.
Диссоциация оснований

Диссоциация оснований - это процесс, в результате которого молекула основания распадается на ионы, образующие раствор в воде или другом растворителе. Основания могут быть как органическими, так и неорганическими веществами.
При диссоциации основания образуют анионы металлов. Анион - это ион с отрицательным зарядом. Основание диссоциирует, так как ионы, образованные в результате распада молекулы, могут связываться с водными молекулами и образовывать растворы.
Водорастворимость оснований зависит от их химического состава и структуры. Некоторые основания диссоциируют полностью, образуя равное количество ионов металлов и гидроксидных ионов. Другие основания диссоциируют не полностью и образуют равновесную систему, в которой присутствуют как молекулы основания, так и ионы.
Диссоциация оснований может играть важную роль в химических реакциях. Например, ионы металлов, образованные при диссоциации основания, могут вступать в реакцию с другими веществами и образовывать новые соединения.
Образование анионов металлов

Основания – это вещества, которые в растворе образуют гидроксид-ионы. В случае металлов, они превращаются в анионы металла и гидроксид-ионы. Образование анионов металлов осуществляется путем диссоциации их соответствующих оснований.
Для некоторых металлов, таких как натрий и калий, образование анионов происходит очень легко и быстро. Это связано с тем, что эти металлы обладают низкой электроотрицательностью и малой величиной заряда, что делает их ионы устойчивыми.
В случае более тяжелых металлов, таких как железо и медь, образование анионов происходит относительно медленно. Это связано с тем, что эти металлы имеют более высокую электроотрицательность и большую величину заряда, что делает ионы менее устойчивыми.
Однако, с помощью катализаторов и повышения температуры, процесс образования анионов металлов можно значительно ускорить. Например, применение металлического катализатора может повысить скорость диссоциации основания и увеличить количество образующихся анионов.
Образование анионов металлов имеет большое значение в химической промышленности и научных исследованиях. Ионы металлов играют важную роль в различных процессах, таких как окислительно-восстановительные реакции, каталитическая активность и электрохимические процессы.
Механизм диссоциации
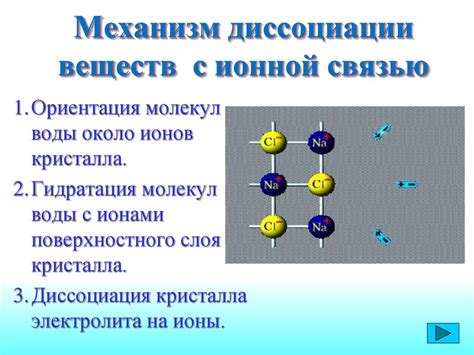
Первым и важнейшим этапом механизма диссоциации оснований является растворение основания в воде. Под влиянием молекул воды металлическое основание покидает кристаллическую решетку и образует комплексы с молекулами воды. Это происходит посредством протекания протолитических (реакций протонного переноса) или координационных (реакций образования комплексов) процессов.
Например, при растворении гидроксида натрия (NaOH) в воде, молекулы воды отделяют натрий и гидроксидные ионы от основания, образуя комплексы [Na(H2O)n]+ и [OH(H2O)m]-, где n и m обозначает количество водных молекул, связанных с ионами.
Далее, основание диссоциирует, то есть распадается на ионы. Этот процесс является обратимым, при этом количество диссоциировавших молекул зависит от концентрации и равновесия в растворе. Ионы основания, такие как Na+ и OH-, свободно движутся в растворе и взаимодействуют с другими ионами и молекулами вещества.
Механизм диссоциации оснований может быть различным в зависимости от химической структуры и свойств основания, а также условий среды. Понимание и изучение механизмов диссоциации оснований позволяет более глубоко понять и прогнозировать их химическую активность и реакционную способность в различных системах и условиях.
Электролитическое равновесие
Электролитическое равновесие – это состояние системы, в которой протекают электролитические реакции, при котором концентрации ионов остаются постоянными. Электролитическое равновесие достигается благодаря балансу между скоростью процесса диссоциации и скоростью обратного процесса, а именно ассоциации ионов.
Электролитическое равновесие имеет важное значение в химических реакциях, особенно в растворах. Оно определяет ионную активность и оказывает влияние на химические свойства раствора. Поэтому изучение и понимание электролитического равновесия позволяет понять, как изменение условий может влиять на состав и свойства раствора.
Электролитическое равновесие описывается различными математическими моделями, такими как закон действующих масс и уравнение Нернста. Они позволяют определить зависимость концентраций ионов от различных факторов, например, от температуры, давления и концентрации реагентов.
Исследование электролитического равновесия является важным для различных областей науки и техники. Оно применяется в аналитической химии для определения концентрации веществ в растворах, в электрохимии для изучения процессов электролиза, а также в биохимии для изучения реакций, происходящих в живых системах.
Практическое применение

Диссоциация оснований и образование анионов металлов являются важными процессами, которые находят свое практическое применение в различных областях.
Одним из основных применений этого процесса является получение солей металлов. Это позволяет использовать их в различных отраслях промышленности, таких как производство покрытий, литейное производство, производство стекла и керамики. Соли металлов также используются в процессах химического анализа и катализа.
Другим важным применением образования анионов металлов является их использование в электрохимических системах. Это позволяет создавать различные типы батарей и аккумуляторов, которые широко применяются в повседневной жизни, в том числе в электронике, транспорте и энергетике.
Также диссоциация оснований и образование анионов металлов являются основой многих методов анализа и исследования. Они используются в химической аналитике для определения концентрации металлов в различных образцах, а также в экологических и биологических исследованиях для изучения влияния металлов на окружающую среду и организмы.
Кроме того, процессы диссоциации оснований и образования анионов металлов применяются в лекарственной промышленности. Они являются основой для синтеза различных лекарственных препаратов, включая препараты, содержащие металлы, и используются в разработке новых методов лечения некоторых заболеваний.
Вопрос-ответ

Какие основания могут диссоциироваться и образовывать анионы металлов?
Диссоциация основания происходит при взаимодействии с водой и образовании гидроксид-ионов. В результате этой реакции образуются анионы металлов, такие как гидроксилиды, оксиды и карбонаты.
Как происходит диссоциация оснований?
Диссоциация основания происходит в присутствии воды, так как основание растворяется в ней и образует гидроксид-ионы. Это происходит в результате протолитической реакции, где вода действует как кислота, а основание как основание.
Можно ли использовать диссоцированные анионы металлов в различных химических реакциях?
Да, диссоцированные анионы металлов можно использовать в различных химических реакциях. Например, гидроксид-ионы могут быть использованы в нейтрализационных реакциях, а оксиды могут быть использованы в окислительно-восстановительных реакциях.
Какие ионы металлов образуются при диссоциации оснований?
При диссоциации оснований могут образовываться различные ионы металлов, такие как гидроксилид-ионы, оксид-ионы и карбонат-ионы. В зависимости от основания, металл и температуры, образующиеся ионы могут иметь различные степени окисления и разные химические свойства.
