Металлы - это классические элементы, которые проявляют уникальные химические свойства при взаимодействии с окружающей средой. Одним из самых интересных и практически важных аспектов их химического поведения являются реакции разложения. Эти реакции играют важную роль в процессе получения и использования металлических материалов.
Важно отметить, что металлы имеют высокую стабильность и необычайную устойчивость к разложению в обычных условиях. Однако они все же могут претерпевать определенные реакции разложения при высоких температурах, в условиях сильных окислительных или восстановительных сред, а также при прямом воздействии электрического тока.
Обычно металлы разлагаются вида М → Mn+ + nе-, где М обозначает металл, Мn+ - положительный ион металла, а nе- - электроны, участвующие в реакции. При разложении металла он теряет свою металлическую структуру и превращается в ионы, которые могут дальше взаимодействовать с другими веществами.
Реакции разложения металлов могут иметь широкий спектр применений в различных областях. Они используются для получения чистых металлов из руды, получения энергии в гальванических элементах или аккумуляторах, а также для создания сложных сплавов с новыми свойствами. Более того, реакции разложения являются основой для процессов нагрева и плавления металлов, что делает их незаменимыми в области металлообработки и производства металлических изделий.
В заключение, реакции разложения металлов представляют собой важный аспект их химического поведения. Они позволяют получать чистые металлы, создавать новые материалы с улучшенными свойствами и использовать энергию, выделяемую при их разложении. Изучение и понимание особенностей этих реакций становится все более актуальным в современном мире, где металлы играют важную роль во многих отраслях науки и техники.
Особенности реакций разложения металлов

Реакции разложения металлов являются важным аспектом их химической активности. Эти реакции происходят при воздействии на металлы высоких температур, кислот, щелочей или других реагентов. Одной из особенностей реакций разложения металлов является то, что они протекают с образованием газов и окислительных или восстановительных продуктов.
Многие металлы имеют склонность к окислению, что приводит к их разложению при воздействии окружающей среды. Например, железо под воздействием влаги и кислорода окисляется и образует ржавчину. Подобное разложение металлов является нежелательным, так как приводит к повреждению изделий из металла и снижению их прочности.
Реакции разложения металлов могут быть источником взрывоопасных ситуаций. Некоторые металлы, такие как натрий и калий, могут взаимодействовать с водой, образуя водородный газ и выделяя большое количество тепла. Это может привести к образованию взрывчатых смесей и возгоранию.
Особенности реакций разложения металлов также связаны с их реакцией с кислотами и щелочами. Некоторые металлы, например, цинк или алюминий, могут реагировать с кислотами, выделяя водородный газ и образуя соответствующую соль металла. При этом металл активно растворяется в кислоте.
В целом, реакции разложения металлов важны для понимания и контроля их химической активности. Они могут быть использованы в промышленности для получения реактивных металлов, но также требуют определенных мер предосторожности из-за их потенциала к взрывам и разрушению материалов.
Реакции разложения металлов и их значение в химии
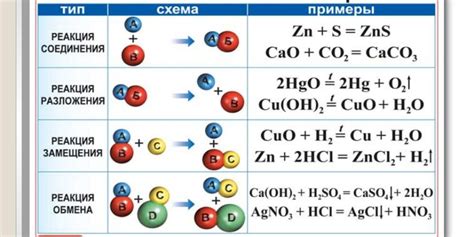
Металлы — это важная группа химических элементов, обладающих высокой теплопроводностью, электропроводностью и механической прочностью. В химии металлы могут участвовать в реакциях разложения, которые имеют большое значение.
Реакции разложения металлов происходят при высоких температурах или взаимодействии с кислотами, основаниями или другими веществами. Одним из наиболее известных примеров является разложение металлических оксидов. При этом металл окисляется, а кислород выделяется в виде газа. Так, например, разложение оксида железа(III) может быть представлено уравнением: Fe2O3 → 2Fe + 3/2O2.
Реакции разложения металлов имеют важное значение в химической промышленности и при производстве различных материалов. Например, разложение металлов позволяет получать чистые металлические элементы или сплавы. Также металлы разлагаются при электролизе для получения металлов в ионообменной форме. При этом металлоксиды превращаются в свободные металлы и окислители.
Реакции разложения металлов также используются при получении водорода. Например, разложение воды на водород и кислород происходит при прохождении электрического тока через воду с использованием металлических электродов. Металлы, такие как цинк или алюминий, выполняют роль электродов и участвуют в разложении воды.
Таким образом, реакции разложения металлов являются важным аспектом химии и находят применение в различных областях. Они позволяют получать чистые металлы, сплавы, водород и другие вещества, что играет важную роль в различных процессах и производствах.
Факторы, влияющие на реакции разложения и выбор металлов

Реакции разложения металлов являются сложными химическими процессами, которые могут подвергаться влиянию различных факторов. Основными из них являются:
- Температура: Повышение температуры может ускорить реакцию разложения металла путем активации его энергетических процессов. Некоторые металлы, такие как алюминий и магний, могут разлагаться уже при комнатной температуре, в то время как для других металлов необходимо нагревание до высоких температур.
- Воздействие окружающей среды: Окружающая среда, включая атмосферу, влажность и наличие кислорода, может оказывать существенное влияние на реакции разложения металлов. Например, некоторые металлы, такие как железо, подвергаются коррозии при воздействии влаги и кислорода, что может ускорить их разложение.
- Содержание примесей: Примеси, такие как газы, кислоты и другие химические вещества, могут также влиять на реакции разложения металлов. Например, некоторые металлы, встречающиеся в рудах, могут содержать серу, которая при разложении образует вредные для окружающей среды серные оксиды.
Выбор металла для конкретной реакции разложения зависит от его свойств и требований процесса. Некоторые металлы, такие как железо и алюминий, широко используются в разных отраслях промышленности благодаря своей прочности и устойчивости к разложению. Другие металлы, такие как свинец и ртуть, редко используются из-за их высокой реактивности и токсичности.
Определение подходящего металла для конкретной реакции разложения требует учета не только факторов, влияющих на саму реакцию, но и требований по стойкости и безопасности процесса. Правильно подобранный металл обеспечит эффективность и надежность разложения, а также минимизацию негативных воздействий на окружающую среду.
Температурные особенности реакций разложения металлов

Реакции разложения металлов часто сопровождаются изменениями температуры. Многие металлы имеют достаточно высокую температуру плавления, поэтому их разложение может начинаться только при высоких температурах.
Однако, существуют и металлы, которые могут разлагаться уже при более низких температурах. Например, металл алюминий начинает разлагаться при температуре около 600 °C. Это связано с его высокой реакционной способностью и способностью образовывать стабильные оксиды.
Также стоит отметить, что некоторые металлы, такие как магний и цинк, могут разлагаться при нагревании в воздухе, что может быть опасным. Поэтому при работе с этими металлами необходима особая осторожность и соблюдение мер безопасности.
Реакции разложения металлов могут протекать при различных температурах в зависимости от свойств и химической активности самих металлов.
Некоторые металлы, например, железо, требуют повышения температуры до очень высоких значений, чтобы началась их разложение. При этом происходит выделение энергии в виде теплоты, что может иметь практическое применение в промышленности.
Процессы разложения металлов при различных температурах имеют большое практическое значение и используются в разных сферах деятельности, включая металлургию, химию, энергетику и другие отрасли.
Влияние окружающей среды на реакции разложения металлов

Реакции разложения металлов представляют собой процессы окисления, растворения или образования соединений с другими веществами. Одним из факторов, оказывающих влияние на эти реакции, является окружающая среда.
Среда, в которой происходит реакция, может влиять на скорость и направленность разложения металлов. Например, влажная среда способствует коррозии металлов, так как присутствие воды обеспечивает разделение на ионы и ускоряет реакции окисления. В то же время, среды с повышенной кислотностью также способствуют ускорению разложения металлов, так как кислоты растворяют и окисляют поверхность металла.
Еще одним фактором, влияющим на реакции разложения металлов, является наличие кислорода в среде. Кислород способствует окислению металлов, образованию оксидов и коррозии. Если воздух содержит влагу, то скорость коррозии увеличивается еще больше из-за ускоренной реакции между металлом и водой.
Цельным примером влияния окружающей среды на реакции разложения металлов является атмосферная коррозия железа. Воздействие кислорода и воды приводит к образованию ржавчины и разрушению металла. Этот процесс можно применить и к другим металлам, таким как алюминий, цинк, медь и т.д.
Химические реакции разложения металлов в различных условиях

Металлы - это элементы, характеризующиеся хорошей проводимостью тепла и электричества, а также способностью сердцевины быстро разлагаться в реакциях. Металлы делятся на активные и пассивные, каждый из которых проявляет особенности при разложении в различных условиях.
Активные металлы, такие как натрий, калий и магний, обладают высокой реакционной способностью и могут разлагаться при взаимодействии с кислородом, водой или кислотами. При взаимодействии с кислородом активные металлы образуют оксиды. Например, натрий при сжигании в кислороде образует оксид натрия, а калий - оксид калия. Вода также вызывает разложение активных металлов, приводя к образованию гидроксидов. Кислоты, такие как серная или азотная, вызывают химическую реакцию, при которой образуются соответствующие соли и выделяется водород.
Пассивные металлы, например, железо, алюминий и цинк, менее реакционноспособны и не разлагаются под воздействием кислорода или воды. Однако, они могут реагировать с кислотами или сильными окислителями, образуя соответствующие соли и выделяяся водород. Например, железо при взаимодействии с соляной кислотой образует соль железа и выделяется водородный газ.
Реакции разложения металлов имеют важное применение в различных сферах. Например, разложение активных металлов, таких как литий, используется в энергетике при создании литий-ионных аккумуляторов. Разложение пассивных металлов научно используется при производстве сплавов и других материалов. Понимание механизмов и особенностей разложения металлов позволяет оптимизировать процессы и расширить их применение.
Углеводороды в реакциях разложения металлов

Реакции разложения металлов являются важным аспектом их химического поведения. Одной из особенностей этих реакций является взаимодействие металлов с углеводородами, что приводит к образованию различных продуктов разложения.
Углеводороды - это органические соединения, состоящие из атомов углерода и водорода. Они могут присутствовать в разных формах, например, в виде алканов, алкенов или алкинов. Реакции разложения металлов с углеводородами обычно происходят при повышенных температурах и в присутствии катализаторов.
При взаимодействии углеводородов с металлами происходит разложение соединений с образованием новых продуктов. Например, реакция металла с алканом может привести к образованию алкена и металлического гидрида. В данной реакции металл выступает в качестве катализатора разложения алкана.
Другим примером реакции разложения металлов с углеводородами является реакция гидрирования. В этой реакции металл вступает во взаимодействие с алкеном и образует алкан. Реакция гидрирования широко используется в промышленности для получения насыщенных углеводородов, таких как пропан и бутан.
Также стоит отметить, что реакции разложения металлов с углеводородами могут протекать с выделением тепла. Высокий уровень энергии в этих реакциях связан с различными структурными особенностями углеводородов и их взаимодействием с металлами.
В заключение, реакции разложения металлов с углеводородами представляют собой сложные химические процессы, которые могут приводить к образованию различных продуктов. Эти реакции играют важную роль в промышленности и научных исследованиях, и их изучение помогает лучше понять особенности химического поведения металлов.
Применение реакций разложения металлов в технологических процессах

Реакции разложения металлов находят широкое применение в различных технологических процессах. Они позволяют получать нужные продукты и материалы, а также производить различные реакции и изменения веществ.
В процессе разложения металлов, обычно используются высокие температуры и вещества, способные разлагать металлы на составные части. Это позволяет получить чистые металлические элементы, которые потом могут быть использованы в различных отраслях промышленности.
Одним из примеров использования реакций разложения металлов является процесс электролиза. При этом процессе, металлы разлагаются под действием электрического тока в растворе солей или электролите. Это позволяет получить чистые металлы, которые имеют большую чистоту и могут быть использованы в различных отраслях промышленности, включая производство электроники и металлических изделий.
В некоторых случаях, реакции разложения металлов используются для получения нужных химических соединений. Например, при разложении меди может образовываться медная соль, которая может использоваться в качестве катализатора или в производстве красителей. Это позволяет получить нужные продукты, которые в дальнейшем могут быть использованы в различных отраслях промышленности.
Таким образом, использование реакций разложения металлов в технологических процессах является важным инструментом для получения нужных продуктов и материалов. Они позволяют производить различные реакции и изменения веществ, что открывает новые возможности в различных отраслях промышленности.
Контроль реакций разложения металлов и предотвращение нежелательных последствий
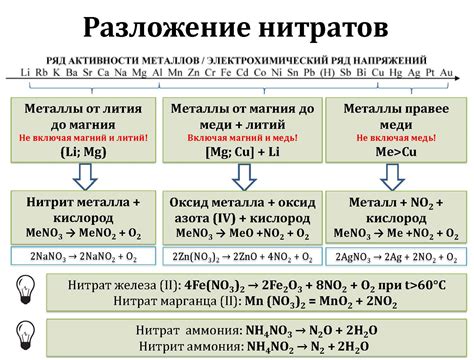
Металлы являются одними из самых распространенных и полезных материалов в промышленности и строительстве. Однако, они могут подвергаться реакциям разложения под воздействием окружающей среды, что может привести к нежелательным последствиям, включая потерю прочности и коррозию.
Для контроля реакций разложения металлов и предотвращения нежелательных последствий применяются различные методы и техники. Одним из основных способов является выбор правильной защитной покрытия для металла. Зачастую это может быть слой оксида, который создает барьер между металлом и окружающей средой, и защищает его от физического или химического взаимодействия.
Другим методом контроля реакций разложения металлов является регулярный мониторинг состояния металла и его окружающей среды. Это позволяет выявить возможные проблемы и принять меры по их предотвращению. Например, проведение испытаний на прочность и коррозию может помочь определить, когда необходимо проводить техническое обслуживание или заменить поврежденные участки металла.
Также важным фактором при контроле реакций разложения металлов является правильное хранение и обработка материалов. Некоторые металлы могут быть особенно чувствительны к воздействию определенных химических веществ или температур, поэтому необходимо соблюдать рекомендации и правила обращения с ними.
В целом, контроль реакций разложения металлов и предотвращение нежелательных последствий является важной задачей, которая требует постоянного внимания и аккуратного обращения с материалами. Соответствующие меры позволяют продлить срок службы металлических изделий, обеспечить их безопасность и сохранить эстетический вид.
Вопрос-ответ

Какие металлы могут подвергаться реакциям разложения?
Многие металлы могут подвергаться реакциям разложения, в особенности при высоких температурах или воздействии кислорода. Например, медь, свинец, цинк и алюминий могут реагировать с кислородом и разлагаться.
Что происходит при реакциях разложения металлов?
При реакциях разложения металлов происходит превращение металлического соединения в металл и другие вещества, как правило, с выделением энергии в виде тепла или света. Например, при разложении оксида меди воздействием тепла, образуется медь и кислород.
Каковы особенности реакций разложения металлов?
Одной из особенностей реакций разложения металлов является их способность к самоокислению, то есть к окислению при взаимодействии с кислородом. Некоторые металлы, такие как алюминий и магний, могут гореть при взаимодействии с кислородом. Кроме того, реакции разложения металлов часто сопровождаются выделением тепла.
Какие факторы влияют на скорость реакций разложения металлов?
Скорость реакций разложения металлов зависит от нескольких факторов, включая температуру, концентрацию реагентов и наличие катализаторов. Высокая температура обычно увеличивает скорость реакции, так как повышает энергию столкновений между молекулами. Концентрация реагентов также влияет на скорость реакции: чем выше концентрация, тем больше столкновений между реагентами. Катализаторы могут ускорять реакцию, снижая энергию активации.
