Окисление металла является процессом, в результате которого металлическая поверхность взаимодействует с кислородом воздуха, образуя окисные соединения. В быту под окислением металла часто подразумевается его коррозия, которая происходит при взаимодействии с влагой или агрессивными средами. Однако, помимо этого, окисление металла может происходить и без образования коррозионных продуктов, но с изменением его цвета.
Изучение явления цвета при окислении металла представляет большой интерес для науки и практики. Многие металлы при окислении образуют различные окисные формы, которые обладают разным цветом. Например, когда медь окисляется на воздухе, она приобретает зеленоватый оттенок. Это объясняется образованием слоя медной патины, состоящего из окиси меди.
Цвет при окислении металла зависит от таких факторов, как состав металла, окислительная среда, а также структура и толщина образовавшегося оксидного слоя. Например, железо при окислении может образовывать разные оксиды, которые имеют разный цвет: желтый оксид железа(III), красно-коричневый оксид железа(III) и черный оксид железа(II).
Окислительная реакция металла

Окислительная реакция металла является процессом, при котором металл взаимодействует с кислородом или другими веществами, приводящими к образованию окиси металла. В результате этой реакции происходит изменение цвета поверхности металла.
При окислении металла первоначально на его поверхности образуется оксидная пленка, которая может иметь различные оттенки цвета, начиная от светло-желтого и до темно-коричневого. Оксидная пленка обычно имеет достаточно плотную структуру, что позволяет защитить металл от дальнейшего окисления.
Некоторые металлы, такие как железо и медь, имеют способность образовывать слой оксида, который обладает хорошей адгезией к поверхности металла. Это позволяет им обеспечивать защиту от коррозии и сохранять долговечность.
Окислительная реакция металла может быть ускорена различными факторами, такими как высокая влажность, наличие солей или кислотных паров в окружающей среде. При этом цвет оксидной пленки может изменяться, что позволяет определить степень окисления металла. Например, в химическом анализе цвет оксидной пленки позволяет судить о концентрации металла в пробе.
Физические процессы при окислении

Окисление металла – это процесс, в котором металлическая поверхность взаимодействует с кислородом из воздуха или воды, приводя к образованию оксидов. При окислении металла происходят следующие физические процессы:
- Коррозия – это распад металла вследствие взаимодействия с окружающей средой. Коррозия может приводить к изменению структуры металла, истончению металлической поверхности и образованию переходных соединений.
- Образование оксидной пленки – при контакте с кислородом металл образует пленку оксида на своей поверхности. Эта пленка может защищать металл от дальнейшего окисления, но также может препятствовать формированию защитной пленки.
- Электролитическая окислительная реакция – эта реакция происходит в присутствии воды и может приводить к образованию гальванической пары между различными металлами, что приводит к более интенсивному процессу окисления.
- Стекловидные и порошкообразные оксиды – в результате окисления металла могут образовываться различные соединения, такие как стекловидные оксиды или порошкообразные соединения, которые могут иметь разные свойства и использоваться для различных целей.
Учет всех этих процессов позволяет лучше понять физическую природу явления окисления металла и применять данную информацию для разработки новых материалов, защиты металла от коррозии и решения других комплексных задач.
Молекулярные превращения металла

Окисление металла – процесс, при котором происходят молекулярные превращения, которые приводят к изменению его цвета. Этот процесс обусловлен взаимодействием металла с кислородом из воздуха или другими окислителями. В результате окисления происходят химические реакции, которые приводят к образованию новых соединений.
Молекулярные превращения металла во время окисления могут происходить различными способами. Например, в случае железа, его окисление может приводить к образованию различных оксидов – FeO, Fe2O3, Fe3O4 и др. В зависимости от конкретного оксида, цвет окисленного железа может варьироваться от желтого до черного.
Одним из наиболее ярких примеров молекулярных превращений металла при окислении является образование ржавчины на поверхности железа. Этот процесс приводит к образованию соединений, содержащих гидроксиды и оксиды железа. Ржавчина обладает характерным красно-коричневым цветом, который вызывается определенным способом устройства плотных химических соединений, фотоэффекта, металлургических факторов.
Изучение молекулярных превращений металла при окислении позволяет более глубоко понять физико-химические свойства металлов и применить этот процесс для получения различных красок, покрытий и материалов с уникальными свойствами. Эта область науки имеет важное прикладное значение и находит применение в различных отраслях промышленности и научных исследованиях.
Влияние внешних факторов на окисление
Процесс окисления металла может быть значительно изменен под воздействием различных внешних факторов. Один из основных факторов, влияющих на скорость окисления, - это влажность окружающей среды. Влажность приводит к образованию воды на поверхности металла, которая стимулирует окислительные реакции. Также влажность может способствовать образованию кислотных растворов, которые ускоряют процесс окисления.
Еще одним важным фактором является температура окружающей среды. При повышении температуры частота окислительных реакций увеличивается, что приводит к более интенсивному окислению металла. Некоторые металлы, такие как алюминий и железо, образуют на поверхности защитную пленку оксида, которая может быть небольшой или плотной в зависимости от температуры окружающей среды.
Также окисление металла может зависеть от концентрации кислорода в воздухе. Более высокая концентрация кислорода способствует более интенсивному окислению металла. Окисление может происходить как на поверхности металла, так и внутри его структуры, особенно при наличии микротрещин или других повреждений.
Наконец, окисление металла может быть повышено или замедлено в зависимости от химической активности окружающей среды. Некоторые вещества, такие как уксусная кислота или соли, могут ускорять окисление, тогда как другие, такие как щелочи или газы, могут замедлять или даже предотвращать его.
Окислительные свойства металлов
Металлы обладают способностью образовывать оксиды, когда они взаимодействуют с кислородом или другими окислителями. При таких реакциях металлы переходят из нейтрального состояния в положительное, при этом их окислительное число увеличивается. Окислительные свойства металлов являются одним из главных факторов, определяющих их химическую активность.
Окислительные свойства металлов варьируют в зависимости от их электрохимических характеристик. Наиболее активные металлы, такие как щелочные металлы (натрий, калий) и щелочноземельные металлы (магний, кальций), обладают сильными окислительными свойствами и быстро реагируют с кислородом воздуха. Они окисляются до соответствующих оксидов уже при комнатной температуре.
Многие металлы образуют пассивные пленки оксидов, которые защищают их поверхность от дальнейшего окисления. Например, алюминий и нержавеющая сталь имеют пассивные пленки оксидов, которые предотвращают реакцию металла с окислителем. Однако, эти пленки могут быть разрушены или повреждены, что может привести к дальнейшей окислительной реакции металла.
Окислительные свойства металлов часто используются в промышленности и научных исследованиях. Например, сплавы с определенными окислительными свойствами используются в процессе анодирования для создания защитных оксидных покрытий на поверхности металла. Эти пленки повышают коррозионную стойкость металла и могут быть окрашены в различные цвета, что делает их полезными в декоративных искусствах и архитектуре.
Роль кислорода в окислительной реакции
Кислород является одним из основных окислителей в окислительной реакции. Он способен отбирать электроны у других веществ, что приводит к окислению данных веществ. Наличие кислорода необходимо для возникновения большинства окислительных реакций, поскольку он может служить активным агентом, способным инициировать процесс окисления.
В окисительной реакции кислород сохраняет свою электроотрицательность и образует соединения с другими веществами. Он обладает большим аффинитетом к электронам и готов приобретать их от других элементов, что делает его отличным окислителем. Процесс окисления связан с передачей электронов от окисляемого вещества к кислороду, что приводит к образованию оксида.
Кислород может быть включен в окислительную реакцию как самостоятельный окислитель, либо может быть частью окислителя. Он часто участвует в окислительных процессах, протекающих в органических и неорганических соединениях. Например, в оксидации металлов кислород является основным окислителем, образуя оксид металла.
Таким образом, кислород играет важнейшую роль в окислительной реакции, способствуя процессу окисления и формированию оксидов. Его высокая активность и способность отбирать электроны позволяют ему взаимодействовать с другими веществами и изменять их свойства, что делает кислород неотъемлемой частью окислительных процессов в природе и в промышленности.
Химические изменения при окислении
Окисление металла – это процесс, при котором металлический материал взаимодействует с кислородом из воздуха или реагентами с содержанием кислорода. На уровне химических реакций, окисление металла сопровождается различными изменениями.
Одним из химических изменений при окислении металла является синтез химических соединений. В результате взаимодействия металла с кислородом или оксидами, образуются оксиды металла, которые могут иметь разнообразные свойства и структуры. Эти соединения могут быть как прочными и стойкими, так и легко разрушаемыми и растворимыми в воде.
В ходе окисления металла также происходит изменение валентности элементов. Валентность – это число, показывающее количество электронов, участвующих в образовании соединения. При окислении металла его валентность увеличивается, тогда как валентность кислорода снижается. Это позволяет металлу перейти из формы металла в форму соединения с кислородом.
Другим химическим изменением, которое происходит при окислении металла, является изменение цвета. Многие металлы обладают характерным незаметным цветом в своей чистой форме, однако, в результате окисления, они могут приобрести другой цвет. Это объясняется образованием оксидной пленки на поверхности металла, которая способна отражать и поглощать определенные длины волн света, в зависимости от химического состава оксида и его толщины.
Изменение цвета при окислении
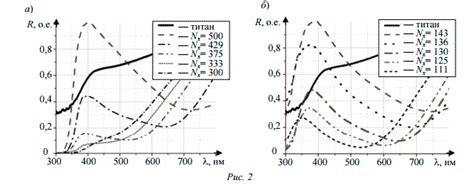
Окисление металлов — это процесс, при котором металл взаимодействует с кислородом воздуха или веществами, содержащими кислород, что приводит к образованию оксидов. Одной из интересных особенностей окисления металлов является изменение цвета вещества.
Цвет оксида металла зависит от химической природы самого металла и его степени окисления. Например, железо при окислении образует черные оксиды, в то время как медь образует зеленые, синие или черные оксиды. Цвет оксида металла обусловлен его электронной структурой и способностью поглощать и отражать различные длины волн света.
Изменение цвета при окислении металла может быть объяснено с помощью понятия "полосы поглощения". При окислении металла происходит переход электронов из одной энергетической области в другую, что приводит к изменению цвета. В результате электроны атома вещества начинают поглощать свет определенных частот, что приводит к изменению его цвета.
Изменение цвета при окислении металла не только представляет научный интерес, но и имеет практическое применение. Например, окрашивание металла в определенный цвет при окислении может быть использовано в декоративных целях или для защиты от коррозии. Кроме того, это явление может быть использовано для создания различных красителей и пигментов.
Исследования окислительного процесса
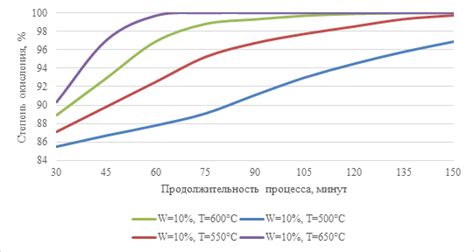
Окисление металлов подвергается интенсивному исследованию учеными в различных областях науки. Это явление изучают как физики, так и химики, а также специалисты в области материаловедения. Исследования окислительного процесса помогают осознать и объяснить различные свойства и характеристики окисленных металлов.
Одним из важных направлений исследований является изучение кинетики окислительного процесса. Ученые стремятся понять, как изменяется скорость окисления металла в зависимости от его свойств, окружающей среды и других факторов. Для этого проводятся эксперименты с различными металлами и изолирующими средами, а также анализируются имеющиеся данные и результаты предыдущих исследований.
Окисление металла также изучается с помощью методов химического анализа. Ученые используют специальные реактивы и приборы для определения состава и структуры окисленного слоя на поверхности металла. Это позволяет выявить химические процессы, происходящие во время окисления, а также оценить образовавшиеся продукты.
Неотъемлемой частью исследований является анализ микроструктуры окисленных металлов. Ученые изучают структуру и форму окисленных частиц, их распределение по поверхности металла и изменение структуры во времени. Для этого используются методы микроскопии и аналитической химии, которые позволяют получить детальные снимки и данные о микроструктуре окисленного слоя.
Вопрос-ответ

Почему металл меняет цвет при окислении?
При окислении металла происходит химическая реакция с окружающим воздухом или другими веществами, которая приводит к образованию окиси на поверхности металла. Изменение цвета происходит из-за образования различных оксидов, которые могут обладать разными цветами. Также окисление может вызывать изменение структуры поверхности металла, что также может влиять на его цвет.
Какие металлы изменяют цвет при окислении?
Почти все металлы могут изменять свой цвет при окислении. Например, железо при окислении образует ржавчину, которая имеет красно-бурую окраску. Медь может покрываться зеленой патиной при взаимодействии с кислородом и другими веществами. Алюминий может образовывать белые, серые или серебристые оксиды в зависимости от условий окисления.
Какие факторы влияют на цвет окисленного металла?
Цвет окисленного металла может зависеть от нескольких факторов. Во-первых, это может зависеть от вида металла, так как разные металлы формируют различные оксиды с разными цветами. Во-вторых, цвет может зависеть от условий окисления, например, от температуры, окружающей среды или наличия других химических веществ. Наконец, цвет может меняться в зависимости от структуры поверхности металла и его оксидов.
Может ли металл изменить свой цвет обратно после окисления?
В некоторых случаях металл может изменить свой цвет обратно после окисления. Например, ржавчина на поверхности железа может быть удалена при помощи специальных средств или механической обработки. Однако в других случаях окисление может быть необратимым и металл останется окрашенным в новый цвет.
