Медь - металл, который имеет широкое применение в различных сферах. Одним из способов получения меди является химическое взаимодействие сульфата меди (CuSO4) с определенными металлами. Этот процесс является важной темой для изучения и понимания особенностей реакций и возможных применений.
Одной из наиболее известных реакций взаимодействия CuSO4 с металлами является redox-реакция. При этом реакции медь замещает другой металл, образуя медный сульфат и обновленный метал. Эта реакция позволяет использовать медный сульфат для получения чистой меди и сплавов с другими металлами.
Кроме того, взаимодействие CuSO4 с металлами может привести к образованию характерных осадков. Например, при реакции с железом (Fe) образуется медный осадок и сульфат железа (FeSO4). Это также отражает способность меди и ее соединений образовывать стабильные соединения с другими элементами.
Изучение химического взаимодействия CuSO4 с металлами имеет важное значение для различных областей науки и технологии. Кроме применений в процессе получения меди, этот процесс может использоваться для разработки новых методов синтеза и получения специальных соединений для использования в различных отраслях промышленности.
Таким образом, изучение взаимодействия CuSO4 с металлами является занимательной и важной темой, которая позволяет расширить наши знания о химических реакциях и применении металлов в различных процессах и технологиях.
Химические реакции Cuso4 с различными металлами
Соединение Cuso4, также известное как сульфат меди, может проявлять различные химические реакции при взаимодействии с различными металлами. Результаты этих реакций обусловлены химическими свойствами каждого конкретного металла и способностью CuSO4 вступать в реакции окисления и восстановления.
При взаимодействии с металлами из группы активных металлов, такими как цинк (Zn), алюминий (Al) или железо (Fe), происходит реакция замещения. В результате этой реакции ион меди, Cu2+, окисляется до медного металла, а выбранный металл восстанавливается до ионной формы. Например, при реакции меди с цинком образуется медь и сульфат цинка.
С другой стороны, при взаимодействии с металлами, которые имеют меньшую активность, такими как серебро (Ag) или золото (Au), реакция не происходит. Это связано с тем, что эти металлы не способны вытеснить медь из CuSO4, так как сильнее связаны с сульфатной группой и проявляют меньшую активность при вступлении в реакции окисления и восстановления.
Также стоит отметить, что при взаимодействии с амфотерными металлами, такими как алюминий (Al) или цинк (Zn), возможна реакция гидролиза, при которой CuSO4 разлагается на гидроксид меди и сульфатный анион. Реакция гидролиза может быть особенно интенсивной в присутствии щелочного или кислого растворов.
В целом, химические реакции Cuso4 с различными металлами могут быть разнообразными и зависят от свойств каждого конкретного металла. Понимание этих реакций позволяет не только изучать химические свойства металлов, но и применять Cuso4 в различных промышленных процессах и лабораторных исследованиях.
Особенности взаимодействия Cuso4 с металлами

Медный(II) сульфат (CuSO4) является химическим соединением, которое проявляет особенности взаимодействия с различными металлами.
Металлы, такие как железо (Fe), алюминий (Al), цинк (Zn), реагируют с CuSO4 и образуют металлические соединения.
В результате взаимодействия медного(II) сульфата с железом образуется осадок меди (Cu) и ионов железа (Fe2+). Эта реакция является реакцией двойной замены.
Что касается алюминия, CuSO4 окисляет его до иона алюминия (Al3+) и при этом сам восстанавливается до меди.
Реакция взаимодействия медного(II) сульфата и цинка приводит к образованию иона цинка (Zn2+) и отложению меди на поверхности цинка.
Однако алюминий (Al) и цинк (Zn) тормозят реакцию взаимодействия Cuso4 с металлами. В присутствии алюминия и цинка медный(II) сульфат несколько медленно или вовсе не реагирует с другими металлами.
Для успешного взаимодействия Cuso4 с другими металлами необходимы условия, способствующие этой реакции, такие как высокая концентрация CuSO4 или увеличение температуры.
Следует отметить, что реактивность металлов также может влиять на взаимодействие с CuSO4. Сильно реакционные и активные металлы, такие как натрий (Na) или калий (K), обесцвечивают раствор медного(II) сульфата и могут вызывать его воспламенение.
Таким образом, взаимодействие Cuso4 с металлами обладает своими особенностями, зависящими от конкретного металла, условий и реактивности металла.
Влияние CuSO4 на электрохимические свойства металлов
Медный (II) сульфат (CuSO4) имеет существенное влияние на электрохимические свойства металлов. При взаимодействии с металлами CuSO4 может происходить ряд химических реакций, в результате которых изменяются их электрохимические свойства.
Одним из вариантов реакции является окисление металла CuSO4 с образованием соответствующего соединения металла и ионов меди. При этом в процессе реакции электрохимические свойства металла могут измениться: металл может становиться более активным или менее активным в реакциях окисления или восстановления.
Также CuSO4 может использоваться в качестве электролита для проведения электролиза. При электролизе раствора медного (II) сульфата на электродах образуются ионы меди и ионы серы. Электрохимические свойства металлов в данном случае могут оказывать влияние на характер и скорость электролитических процессов.
Реакции взаимодействия CuSO4 с металлами и их последующие электрохимические свойства широко используются в различных областях, включая электрохимию, гальванику, производство и технологии. Понимание этих процессов позволяет более эффективно использовать металлы и их соединения в различных приложениях и разрабатывать новые материалы и технологии.
Формы, в которых Cuso4 может взаимодействовать с металлами
Сульфат меди(II) (CuSO4) является одной из форм меди, которая может взаимодействовать с различными металлами. Это соединение широко использовалось в лабораторных и промышленных процессах из-за своих уникальных химических свойств.
Одной из основных форм, в которых Cусо4 может взаимодействовать с металлами, является раствор. При растворении сульфата меди(II) в воде образуется ионная форма соединения - Cu2+ и SO4^2-. Это позволяет металлам взаимодействовать с ионами меди и сульфата в растворе, образуя различные химические соединения.
Важно отметить, что сульфат меди(II) также может принимать форму кристаллов. Эти кристаллы широко используются в процессе электрохимического осаждения меди на другие металлы. Это позволяет создавать покрытия из меди на поверхности различных материалов, усиливая их электропроводимость и защищая от коррозии.
Кроме того, Cuso4 может взаимодействовать с металлами в форме комплексов. Медь может образовывать комплексные соединения с другими металлами, такими как цинк, железо, никель и другие. Эти комплексы обладают разными химическими и физическими свойствами, что позволяет использовать их в различных областях, включая каталитические процессы и производство сплавов.
Роль СuSO4 в процессах гальванического покрытия металлов
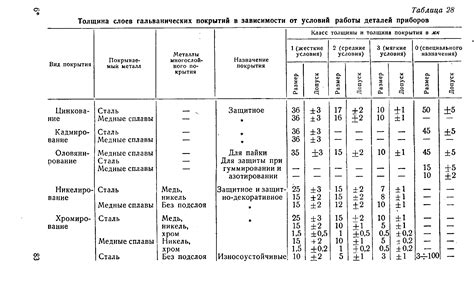
Сульфат меди (CuSO4) является одним из основных компонентов в процессах гальванического покрытия металлов. Этот химический соединение играет важную роль в образовании электролитов, используемых для создания покрытий на поверхности различных металлов.
В процессе гальванического покрытия металлов CuSO4 используется в качестве источника иона меди (Cu2+). Эти ионы присутствуют в специально подготовленном электролите, который состоит из водного раствора CuSO4. Ионы меди играют важную роль в химической реакции, происходящей на поверхности металла.
В процессе гальванического покрытия металлов, ионы меди перемещаются со специально подготовленной анодной поверхности на ионно-проводящий материал, который является катодом. При этом происходит окисление меди на аноде и восстановление на катоде, что приводит к образованию покрытия на поверхности металла.
Использование CuSO4 в процессах гальванического покрытия металлов позволяет получать качественные и прочные покрытия с высокой стойкостью к коррозии. Кроме того, этот химический соединение обеспечивает регулирование процесса покрытия, контроль его толщины и равномерность. Все это делает CuSO4 одним из основных и необходимых компонентов в гальванической промышленности.
Возможные применения Cuso4 в металлургической отрасли

Сульфат меди (CuSO4) имеет широкий спектр применений в металлургической отрасли благодаря своим полезным химическим свойствам. Этот соединение может использоваться для гальванического покрытия металлов, обеспечивая защиту от коррозии и улучшение эстетического вида изделий. Применение CuSO4 в промышленности также обусловлено его способностью служить катализатором в реакциях окисления и восстановления металлов.
Одним из важных применений CuSO4 является его использование в процессе гальванического покрытия. При этом соединение используется в электролите, который содержит ионы меди. При проведении электрического тока через электролит, ионы меди осаждается на поверхности металла, обеспечивая равномерное и прочное покрытие. Такое гальваническое покрытие может использоваться для защиты металла от коррозии и предоставления декоративного эффекта.
Кроме того, CuSO4 может использоваться в качестве катализатора в различных реакциях металлургического процесса. Например, он может применяться в реакциях окисления и восстановления, которые необходимы для получения чистых металлических соединений или сплавов. CuSO4 может служить активной компонентой катализатора, ускоряя химические реакции и повышая эффективность процесса.
Также CuSO4 может использоваться для нейтрализации нежелательных химических соединений, которые могут образовываться во время металлургического процесса. Например, он может помочь уменьшить содержание серы в металле, что снизит его вязкость и повысит его качество. Кроме того, CuSO4 может использоваться в процессе очистки металлической поверхности от загрязнений и окислов, обеспечивая лучшую адгезию при последующей обработке или покрытии.
Особенности химических реакций Cuso4 с редкоземельными металлами
Взаимодействие Cuso4 с редкоземельными металлами представляет особый интерес в химии, так как оно происходит с образованием сложных соединений и может иметь различные последствия.
При реакции Cuso4 с редкоземельными металлами обычно образуется соединение типа Mso4, где M обозначает редкоземельный металл. Такие соединения обладают различными свойствами, в зависимости от конкретного металла, с которым взаимодействуют.
Например, реакция Cuso4 с лантаном приводит к образованию сульфата лантана, который характеризуется высокой растворимостью в воде и является ярким фиолетовым соединением. Возможно образование гексагидратов Mso4·6H2O, которые обладают хорошей растворимостью и могут использоваться в различных химических процессах.
В результате взаимодействия Cuso4 с редкоземельными металлами могут образовываться также комплексные соединения, которые имеют сложную структуру и могут обладать специфическими свойствами. Например, комплексное соединение Cuso4 с дунитом (Ni3Fe) имеет магнитные свойства и используется в магнитных материалах.
Таким образом, взаимодействие Cuso4 с редкоземельными металлами представляет большой интерес для исследования и может приводить к образованию разнообразных соединений с уникальными свойствами.
Вопрос-ответ

Что такое CuSO4?
CuSO4 - это химическое соединение меди и серы, которое обычно называется сульфатом меди.
Какие химические реакции происходят между CuSO4 и металлами?
Сульфат меди может взаимодействовать с многими металлами, образуя различные химические соединения. Например, реакция с железом приводит к образованию синего осадка, реакция с цинком приводит к выделению металла и образованию белого осадка. Также сульфат меди может реагировать с алюминием, свинцом и другими металлами.
Какие особенности есть при взаимодействии CuSO4 с металлами?
Одна из особенностей взаимодействия CuSO4 с металлами заключается в том, что сульфат меди может восстановиться до элементарного состояния меди, например, при взаимодействии с железом. Также стоит отметить, что не все металлы активно реагируют с сульфатом меди, и реакционная способность может зависеть от таких факторов, как концентрация реагентов и условия реакции.
Зачем изучать взаимодействие CuSO4 с металлами?
Изучение взаимодействия CuSO4 с металлами позволяет понять химическую активность сульфата меди и его возможное применение в различных областях, например, в химической промышленности, при производстве электроники или при разработке новых материалов. Также такие исследования могут помочь улучшить процессы переработки и вторичного использования металлов.
