Щелочные металлы — это группа элементов периодической системы, которые включают в себя литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они характеризуются высокой химической реактивностью и способностью образовывать соединения с различными элементами. Во многих отношениях эти металлы ведут себя подобно друг другу.
Химическая реактивность щелочных металлов проявляется в их способности активно взаимодействовать с водой, кислородом и кислотами. Например, при контакте с водой щелочные металлы образуют щелочные растворы, которые имеют характерные особенности, такие как щелочной вкус и способность изменять цвет красителей. Кроме того, щелочные металлы легко окисляются на воздухе и образуют оксиды, пероксиды или супероксиды.
Одной из особенностей щелочных металлов является их способность образовывать ионы с положительным зарядом. Это связано с тем, что электроны в их внешней электронной оболочке легко отдаются, образуя положительно заряженные ионы. В результате этого щелочные металлы становятся хорошими восстановителями и активными элементами в химических реакциях.
Химические свойства щелочных металлов находят широкое применение в различных отраслях науки и техники. Например, их соединения используются в производстве стекла, щелочных батарей, чистых металлических поверхностей и других материалов. Кроме того, щелочные металлы играют важную роль в биохимии и медицине, где они применяются в качестве лекарственных препаратов и элементов питания для организма.
В заключение, свойства щелочных металлов связаны с их высокой химической реактивностью, способностью к образованию ионов с положительным зарядом и активным участием во множестве химических реакций. Эти металлы имеют широкое применение в различных областях и играют важную роль в науке и технике, а также в биохимии и медицине.
Электроотрицательность и металлический характер

Электроотрицательность - это способность атома привлекать к себе электроны в химической связи. Щелочные металлы, такие как литий (Li), натрий (Na), калий (K) и дргие, обладают низкой электроотрицательностью. Это означает, что они имеют большую склонность отдавать электроны в химических реакциях.
Металлический характер щелочных металлов обусловлен их способностью образовывать ионные связи с другими элементами. Щелочные металлы обычно образуют положительно заряженные ионы, те катионы, так как отдают один электрон, чтобы достичь электронной конфигурации инертного газа.
Катионы щелочных металлов обладают высокой реактивностью и способностью взаимодействовать с отрицательно заряженными анионами, такими как хлор (Cl), оксид (O), гидрид (H) и другими. Эта реактивность щелочных металлов объясняется их металлическим характером и низкой электроотрицательностью.
Металлический характер щелочных металлов также проявляется в их физических свойствах, таких как блеск и хорошая проводимость электричества и тепла. Щелочные металлы обладают мягкостью и низкой плотностью, что делает их легкими и удобными для использования в различных промышленных и технических приложениях.
Атомный радиус и реактивность
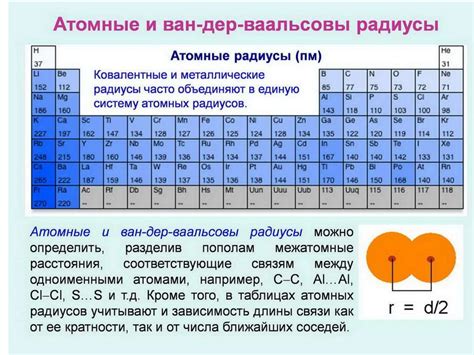
Атомный радиус щелочных металлов, таких как литий, натрий и калий, является очень большим. Это связано с тем, что атомы этих металлов имеют низкую электроотрицательность и малое число электронных оболочек. За счет этого, электроны внешней оболочки находятся далеко от положительно заряженного ядра и, следовательно, атомный радиус увеличивается.
Большой атомный радиус щелочных металлов обусловливает их высокую химическую реактивность. Они легко вступают в химические реакции и образуют соединения с другими элементами. Это связано с тем, что щелочные металлы имеют один или два электрона во внешней оболочке и стремятся избавиться от этих электронов, чтобы достичь стабильной электронной конфигурации.
Щелочные металлы реагируют с водой, образуя щелочные растворы и выделяя водород. Кроме того, они вступают в реакцию с кислородом, образуя окислы. Реакция щелочных металлов с кислородом часто сопровождается большим выделением тепла и является очень взрывоопасной.
Кроме того, щелочные металлы реагируют с другими неметаллами, образуя соли. Например, калий реагирует с серой, образуя сернистый калий, который используется в промышленности при производстве целлюлозы и бумаги. Эти реакции основаны на обмене ионами и позволяют щелочным металлам образовывать стабильные и химически инертные соединения.
Восстановительные свойства щелочных металлов

Щелочные металлы, такие как литий, натрий, калий и др., обладают высокими восстановительными свойствами. Они легко отдают свои электроны другим веществам и способны восстанавливать положительные ионы, придавая им отрицательный заряд.
Это свойство делает щелочные металлы отличными восстановителями в химических реакциях. Они могут реагировать с различными веществами, окисляться и при этом сами восстанавливаться. Например, реакция щелочных металлов с водой протекает с образованием гидроксида металла (щелочи) и выделением водорода.
Восстановительные свойства щелочных металлов проявляются также в их реакции со многими неметаллами. Например, с кислородом они реагируют с образованием оксидов металлов. С хлором или бромом реакция протекает с образованием хлорида или бромида металла.
Щелочные металлы также способны восстанавливать тугоплавкие металлы, такие как железо, титан, алюминий и другие. Их способность к восстановлению приводит к тому, что они активно используются в металлургии и различных производствах.
Восстановительные свойства щелочных металлов являются одной из основных характеристик, определяющих их химическую активность. Они играют важную роль во многих химических реакциях и находят широкое применение в различных отраслях промышленности и науки.
Образование гидроксидов
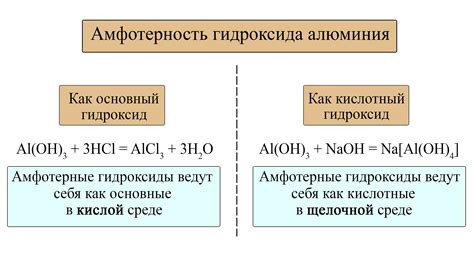
Щелочные металлы обладают выраженной химической реактивностью, поэтому они с легкостью образуют гидроксиды. Гидроксиды щелочных металлов, такие как гидроксид натрия (NaOH), гидроксид калия (KOH) и гидроксид лития (LiOH), являются основаниями сильной щелочности.
При реакции щелочных металлов с водой образуются гидроксиды и высвобождается водородный газ. Например, реакция натрия с водой выглядит следующим образом:
2Na + 2H2O → 2NaOH + H2
Гидроксиды щелочных металлов обладают сильной щелочностью и обычно легко растворяются в воде. В растворах гидроксидов обнаруживается ионный характер, присутствуют оксид-ионы (например, OH-) и катионы щелочного металла.
Образование гидроксидов щелочных металлов является важным процессом в химической промышленности. Гидроксиды используются для производства щелочей, жидких и твердых мыл, и других химических продуктов.
Способность к реакции с кислородом
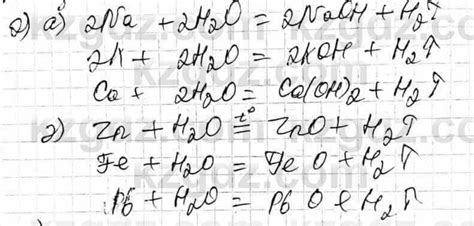
Щелочные металлы обладают высокой способностью к реакции с кислородом. При взаимодействии с воздухом они образуют оксиды, которые обладают различными свойствами. Например, натрий при контакте с воздухом образует натриевый оксид (Na2O), который представляет собой безцветную кристаллическую соль. Калий, в свою очередь, образует калиевый оксид (K2O), который имеет темно-коричневый цвет.
Эти оксиды щелочных металлов могут реагировать с водой, образуя гидроксиды. Например, натриевый оксид взаимодействует с водой, образуя натриевую гидроксид (NaOH). Это щелочь, которая обладает широким спектром применения в различных отраслях промышленности и бытовых нуждах.
Реакция щелочных металлов с кислородом также может протекать в составе пероксида. Например, натрий может образовывать пероксид натрия (Na2O2), который представляет собой белый кристаллический порошок. Этот вещество используется в качестве окислителя и отбеливателя в различных отраслях промышленности, а также в медицине и бытовой химии.
Способность к растворению в водах и реакции с водой

Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, обладают высокой способностью растворяться в водах. Это связано с положительным зарядом и малой размерностью ионов этих металлов, что позволяет им легко проникать в межмолекулярный пространство воды.
При контакте щелочных металлов с водой происходит быстрая и реактивная химическая реакция. Главной особенностью этой реакции является выделение водорода и образование гидроксида щелочного металла в виде раствора. Реакция щелочных металлов с водой сопровождается сильным выделением энергии в виде тепла, и в некоторых случаях может быть даже взрывоопасной.
Реакция щелочных металлов с водой и образование гидроксида выражает их химическую реактивность. За счет образования гидроксидов щелочные металлы проявляют сильные щелочные свойства, проявляющиеся в щелочной реакции с кислотами, нейтрализующей их и образующей соль и воду.
Таким образом, способность щелочных металлов к растворению в водах и реакции с водой предопределяет их химические свойства и использование в различных областях, от производства химических реактивов до применения в батареях и аккумуляторах.
Образование бинарных соединений

Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, легко образуют бинарные соединения с другими элементами. Бинарное соединение - это соединение, состоящее только из двух элементов.
Образование бинарных соединений щелочными металлами основано на их высокой химической реактивности. Щелочные металлы имеют один электрон во внешней электронной оболочке, что делает их нестабильными и склонными к образованию ионов с положительным зарядом.
Когда щелочные металлы реагируют с другими элементами, они отдают свой внешний электрон, образуя положительно заряженные ионы. Эти ионы затем соединяются с отрицательно заряженными атомами других элементов, образуя стабильные бинарные соединения.
Примером бинарных соединений, образованных щелочными металлами, являются хлориды, бромиды, иодиды и фториды щелочных металлов. Например, хлорид натрия (NaCl) образуется при реакции натрия с хлором. Эти бинарные соединения имеют высокую устойчивость и широко применяются в различных отраслях, включая химическую промышленность, фармацевтику и пищевую промышленность.
Влияние щелочных металлов на окружающую среду и человеческий организм

Щелочные металлы, такие как литий, натрий и калий, являются важными элементами, использующимися в различных сферах жизни, начиная от промышленности и электроники до медицины и пищевой промышленности. Однако их негативное воздействие на окружающую среду и человеческий организм необходимо учитывать и контролировать.
Химическая реактивность и свойства щелочных металлов
Щелочные металлы характеризуются высокой реактивностью, что означает их способность быстро и сильно взаимодействовать с другими веществами. Они сильно реагируют с водой, выделяясь очень горючими и отравляющими газами, такими как водород и аммиак. Кроме того, они могут вызывать коррозию различных материалов, таких как металлы и стекло.
Воздействие на окружающую среду
Использование щелочных металлов может иметь серьезное воздействие на окружающую среду. Например, высокие концентрации щелочных металлов в воде могут привести к изменению pH, что негативно сказывается на рыбах, растениях и других организмах, находящихся в водной среде. Кроме того, выбросы щелочных металлов в атмосферу могут приводить к загрязнению воздуха и вызывать проблемы с дыханием и здоровьем людей.
Воздействие на человеческий организм
Прямой контакт с щелочными металлами или их соединениями может быть опасен для человеческого организма. Они могут вызывать раздражение и ожоги кожи и слизистых оболочек, а также приводить к отравлениям при попадании в организм через пищу или дыхательные пути. Кроме того, некоторые исследования показывают, что длительное воздействие щелочных металлов может быть связано с различными заболеваниями, такими как рак и нейрологические расстройства.
Для уменьшения негативного воздействия щелочных металлов на окружающую среду и человеческий организм необходимо применять эффективные методы управления и контроля их использования и выбросов. Это может включать меры по снижению выбросов их производства и использования, а также эффективную обработку отходов и повышение осведомленности о возможных рисках, связанных с этими элементами.
Вопрос-ответ

Зачем нужно изучать свойства щелочных металлов?
Изучение свойств щелочных металлов важно для понимания их химической реактивности и влияния на окружающую среду. Также это помогает разрабатывать новые и улучшенные материалы и технологии.
Какова химическая реактивность щелочных металлов?
Щелочные металлы обладают высокой химической реактивностью, то есть они активно взаимодействуют с другими веществами, особенно с водой и кислородом. Например, они могут вызывать горение или реагировать с водой, образуя щелочные растворы.
Какие особенности есть у щелочных металлов?
Одной из особенностей щелочных металлов является то, что они имеют низкую плотность и низкую температуру плавления, что делает их мягкими и легкими для обработки. Кроме того, они имеют высокую электроотрицательность и образуют водорастворимые соединения, обладающие щелочными свойствами.
