Металлы — одна из основных групп веществ, которые демонстрируют реактивность при контакте с кислотами. Данное явление лежит в основе множества процессов в химии и применяется в различных технологиях. Реакция металлов на кислоты связана с образованием солей и выделением водорода.
Взаимодействие металлов с кислотами обусловлено их химической природой. Металлы представляют собой элементы, у которых наружные электронные оболочки слабо удерживаются ядром, и они представляются ионами с положительным зарядом. Кислоты же, в свою очередь, обладают электронной плотностью и способны отдавать протоны - положительно заряженные частицы. При контакте между собой металла и кислоты происходит обмен электронами и протонами, что и вызывает реакцию.
Реакция металлов на кислоты может быть разной и зависит от конкретной комбинации веществ. Некоторые металлы, например, железо или цинк, активно реагируют с различными кислотами, выделяя водород газ. Другие, такие как алюминий или свинец, образуют соли в результате взаимодействия с кислотными растворами. Интенсивность реакции зависит не только от металла и кислоты, но и от условий эксперимента, таких как температура или концентрация раствора.
Реакция металлов на кислоты: особенности взаимодействия

Реакция металлов на кислоты - явление, которое активно изучается в химии. Металлы взаимодействуют с кислотами и образуют новые соединения, при этом проявляются различные особенности и свойства каждого металла.
Один из ключевых факторов, влияющих на реакцию металла с кислотой, - это активность металла. Более активные металлы, такие как натрий, калий и алюминий, способны реагировать с кислотой намного более интенсивно, образуя сильные взрывоопасные реакции.
Однако, не все металлы реагируют с кислотами. Некоторые металлы, такие как золото и платина, не реагируют с кислотами и остаются стабильными при взаимодействии с ними.
Реакции металлов с кислотами могут проявляться в различных формах. Например, в случае реакции цинка с соляной кислотой, образуется соль и выделяется водород. Этот процесс часто сопровождается выделением газа и пузырьками.
Также следует учитывать, что каждая кислота взаимодействует с металлом по-разному. К примеру, соляная кислота реагирует с металлами гораздо интенсивнее, чем уксусная кислота.
Таким образом, реакция металлов на кислоты имеет свои особенности, зависящие от активности металла, его химических свойств и характеристик кислоты. Изучение этого явления позволяет понять взаимодействие металлов и кислот, а также применять этот знания в различных областях, включая промышленность и науку.
Важный фактор - тип кислоты

Реакция металлов на кислоты зависит от различных факторов, и одним из них является тип кислоты, с которой взаимодействует металл. Разные кислоты могут вызывать разные реакции металлов, так как они имеют разную силу и химический состав.
Сильные минеральные кислоты, такие как серная, соляная и азотная кислоты, обладают высокой концентрацией и способны быстро реагировать с металлами. При взаимодействии с этими кислотами металлы могут выделяться в виде пузырьков газа, сопровождаться шипением и наблюдаться выделение тепла.
Некоторые металлы имеют способность реагировать только с конкретными типами кислот. Например, реакция железа с соляной кислотой проявляется в выделении водорода, тогда как цинк может реагировать с соляной и серной кислотами, выделяя гидрогенсульфид.
Также важно учитывать, что некоторые кислоты, такие как уксусная или фосфорная кислоты, являются слабыми и не вызывают таких ярких реакций с металлами, как сильные минеральные кислоты. Однако, даже при слабой концентрации, они могут влиять на поверхность металла и вызывать его коррозию.
Различная агрессивность кислот
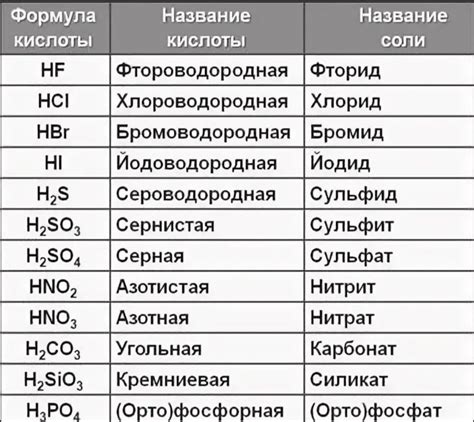
Кислоты характеризуются различной степенью агрессивности при взаимодействии с металлами. Это связано с их способностью образовывать ионные соединения с металлами. Некоторые кислоты более активно взаимодействуют с определенными металлами, в то время как другие металлы могут быть устойчивы к их действию.
Сильные минеральные кислоты, такие как серная и хлороводородная кислоты, обладают высокой агрессивностью и легко реагируют с большинством металлов. Они способны разрушать структуру металла и образовывать растворимые соли. Например, хлороводородная кислота растворяет многие металлы, такие как железо, цинк и алюминий, образуя хлориды металлов.
Уксусная кислота и некоторые другие слабые органические кислоты имеют меньшую агрессивность по сравнению с минеральными кислотами. Они обычно реагируют с металлами, образуя растворимые ацетаты. Некоторые металлы, такие как золото и платина, обладают высокой устойчивостью к действию таких кислот и могут быть использованы для их хранения и транспортировки.
Общая агрессивность кислоты также зависит от их концентрации. Чем выше концентрация кислоты, тем более активно она реагирует с металлами. Для безопасности использования кислот в лабораторных условиях и в промышленности важно соблюдать правильную концентрацию и соотношение кислоты с металлом.
Эффекты образования солей и газов
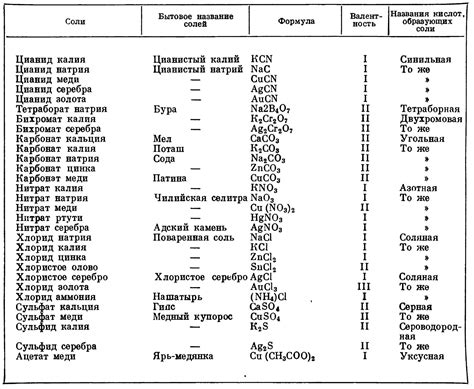
Реакция металлов с кислотами приводит к образованию солей и выделению газов. Образование солей - это основная химическая реакция, происходящая при взаимодействии металлов с кислотами. Соли образуются благодаря обмену ионами между металлами и кислотами.
Газы, выделяющиеся при реакции металлов с кислотами, включают водород и диоксид углерода. Водород выделяется при взаимодействии активных металлов, таких как цинк или алюминий, с кислотами. Диоксид углерода образуется при реакции карбонатов металлов, например, кальция или магния, с кислотами.
Реакция образования солей и газов может сопровождаться различными эффектами. Например, при выделении газов могут возникать пузырьки, которые поднимаются вверх. Также может наблюдаться пена или пенообразование в результате химической реакции.
Для наглядности результатов реакции металлов с кислотами можно использовать таблицу, в которой указать название металла, кислоты, образовавшуюся соль и выделенный газ. Также можно привести примеры конкретных реакций между металлами и кислотами, таких как реакция меди с серной кислотой, реакция железа с соляной кислотой и другие.
Главные реакции при взаимодействии
Известно, что многие металлы проявляют активность при взаимодействии с кислотами. Основной вид реакций, наблюдаемых при таком взаимодействии, это образование солей и выделение водорода. Каждый металл взаимодействует с кислотами в соответствующем ему реакционном ряду, который зависит от его атомного номера.
1. Реакции щелочных металлов с кислотами:
- Щелочные металлы (например, натрий, калий) взаимодействуют с кислотами, образуя соли и выделяя водород. Например, натрий + соляная кислота = хлорид натрия + водород;
- Реакции также зависят от концентрации кислоты: концентрированные кислоты способствуют сильному выделению водорода;
- Водородные соли щелочных металлов легко растворяются в воде и образуют щелочи — гидроксиды.
2. Реакции переходных металлов с кислотами:
- Переходные металлы (например, железо, медь) взаимодействуют с кислотами, образуя соли и выделяя водород. Например, железо + соляная кислота = хлорид железа + водород;
- Некоторые переходные металлы, такие как цинк и алюминий, могут образовывать пассивную окисную пленку на поверхности, что замедляет их реакцию с кислотами;
- При взаимодействии с концентрированными кислотами могут образовываться побочные реакции, такие как выделение газов, окисление металла и т.д.;
- В некоторых случаях металлы могут взаимодействовать с кислотами только при нагревании.
Таким образом, реакции металлов с кислотами включают образование солей и выделение водорода. Важные факторы, влияющие на эти реакции, включают тип металла, тип кислоты, их концентрацию и температуру взаимодействия. Изучение этих реакций помогает понять особенности взаимодействия металлов с кислотами и их применение в различных областях.
Влияние физических условий

Взаимодействие металлов с кислотами может существенно зависеть от физических условий, в которых происходит реакция. Одним из таких условий является температура реакционной среды. При повышении температуры может усилиться активность металла, что приведет к более интенсивному разложению кислоты и образованию газов. Например, металлы алюминий и цинк могут начать реагировать с кислотами при комнатной температуре, но при нагревании эта реакция может происходить уже значительно быстрее и интенсивнее.
Влияние концентрации кислоты также играет важную роль. При увеличении концентрации кислоты может усилиться скорость реакции с металлом и образование газовых продуктов. Также концентрация кислоты может определять степень коррозионной активности металла. Например, различные металлы могут проявлять разную степень коррозионной активности в кислотах разной концентрации.
Один из факторов, который может влиять на взаимодействие металлов с кислотами, это масса металла. Чем больше масса металла, тем больше его поверхность будет контактировать с кислотой, что в свою очередь может ускорить процесс реакции. Также масса металла может определять количество образующегося газа при реакции. Например, большая масса металла может привести к большему количеству образованного водорода при взаимодействии с кислотой.
Безопасность при осуществлении реакции

При осуществлении реакции металлов с кислотами необходимо соблюдать определенные меры безопасности, чтобы предотвратить возможные риски и аварийные ситуации. Во-первых, необходимо надеть защитные очки и резиновые перчатки, чтобы защитить глаза и кожу от кислотных паров и попадания кислоты на кожу.
Во-вторых, необходимо работать в хорошо проветриваемом помещении или под вытяжным шкафом, чтобы избежать вдыхания опасных кислотных паров. Также следует избегать попадания кислоты на одежду, чтобы избежать ее разъедания или возгорания.
При выборе кислоты для проведения реакции необходимо учитывать ее концентрацию и характеристики, чтобы избежать использования слишком сильных или опасных кислот. Также необходимо соблюдать правила хранения и использования кислоты для предотвращения ее утечки или неправильного обращения.
В случае непредвиденных обстоятельств, таких как попадание кислоты на кожу или в глаза, необходимо незамедлительно промыть область большим количеством воды и обратиться к врачу. При возникновении пожара необходимо немедленно вызывать пожарных и использовать огнетушитель на базе углекислого газа.
Таким образом, соблюдение мер безопасности при осуществлении реакции металлов с кислотами является важным условием для предотвращения возможных опасностей и аварийных ситуаций. Бережное и ответственное обращение с кислотами поможет избежать травм и сохранить здоровье.
Вопрос-ответ

Какие виды металлов реагируют с кислотами?
С кислотами могут реагировать различные виды металлов, но наиболее активными являются щелочные металлы, такие как натрий, калий, литий, а также металлы из группы железа, вроде железа, цинка и алюминия. Металлы из группы платины и золота не реагируют с кислотами.
Что происходит при реакции металла с кислотой?
При реакции металла с кислотой происходит образование соли и выделение водорода. Металл с ионами водорода из кислоты образуют соль, а освобождающийся при этом водород выделяется в виде пузырьков. Это может быть сопровождено выделением тепла и образованием пены.
Какая концентрация кислоты влияет на скорость реакции с металлом?
Скорость реакции металла с кислотой зависит от концентрации кислоты. Обычно, чем выше концентрация кислоты, тем быстрее происходит реакция. Это связано с тем, что более концентрированная кислота имеет большее количество ионов в растворе, что увеличивает вероятность столкновения и взаимодействия металла с ионами водорода, ускоряя реакцию.
Почему металлы из группы платины и золота не реагируют с кислотами?
Металлы из группы платины и золота не реагируют с кислотами, потому что они являются химически инертными. Это связано с тем, что у них высокая степень устойчивости к химическим реакциям. Платина и золото не образуют ионы в растворе, поэтому они не могут образовывать соли и выделять водород при реакции с кислотами.
