Металлы - это группа химических элементов, обладающих определенными физическими и химическими свойствами. Они обычно отличаются высокой теплопроводностью, электропроводностью и блеском. Металлы обычно находятся на левой стороне таблицы химических элементов, но есть и несколько металлов на правой стороне.
Одна из самых важных ролей металлов в химических реакциях - это их способность образовывать ионный связанные соединения. Металлы имеют тенденцию отдавать электроны, образуя положительно заряженные ионы. Эти ионы могут образовывать связи с отрицательно заряженными ионами, такими как кислород, сера и неметаллы, образуя различные химические соединения, такие как оксиды, сульфиды и соли.
Металлы также могут служить как катализаторы в химических реакциях. Катализаторы ускоряют химические реакции, не изменяя своей структуры. Металлы, такие как платина, никель и железо, являются эффективными катализаторами в различных промышленных процессах и важными компонентами автокатализаторов в автомобильных силовых установках.
Металлы также играют роль в электрохимических реакциях, таких как электролиз и гальванические элементы. В электролизе металлы могут быть осаждены на электроде, а также отдавать или принимать электроны, что позволяет передавать электрическую энергию через электролит. В гальваническом элементе металлы играют роль анода и катода, их взаимодействие приводит к генерации электрического тока.
Металлы: основные свойства и их роль в химических реакциях

Металлы – это класс элементов, характеризующихся высокой электропроводностью, блеском, способностью образовывать ионы и обладающих высокой пластичностью и твердостью. Основные свойства металлов связаны с наличием у них свободных электронов, которые образуют электронное облако или «море электронов», существующее между положительно заряженными ионами металла.
Роль металлов в химических реакциях велика и многообразна. Благодаря своей способности образовывать ионы, металлы могут участвовать в реакциях с другими веществами и образовывать соединения различных типов. Одним из основных примеров реакций, в которых участвуют металлы, являются окислительно-восстановительные процессы. В реакциях окисления металлы отдают электроны, становясь положительно заряженными ионами. В реакциях восстановления металлы принимают электроны и образуют нейтральные атомы или ионы.
Металлы также могут образовывать соли при реакции с кислотами. В данном случае металлы отдают свои электроны, образуя положительно заряженные ионы металла, а кислоты принимают электроны, образуя отрицательно заряженные ионы. Таким образом, образуется соль – соединение металла и кислоты. Также металлы могут образовывать сплавы, смешиваясь с другими металлами.
Металлы играют важную роль в химической промышленности и занимают особое место в современной технологии. Они используются для производства различных материалов – от стали и алюминия до редких металлов, используемых в электронике. Также металлы широко применяются в производстве батарей, проводов, медицинского оборудования и многого другого. Благодаря своим уникальным свойствам металлы стали неотъемлемой частью нашего современного мира.
Определение и классификация металлов
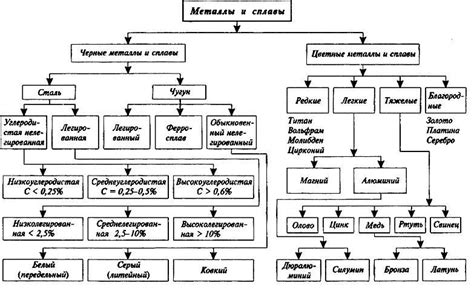
Металлы - это химические элементы, которые характеризуются блеском, хорошей тепло- и электропроводностью, а также способностью образовывать ионы положительного заряда.
Металлы можно классифицировать по различным признакам. Один из наиболее распространенных способов классификации - это разделение на легкие и тяжелые металлы. Легкие металлы, такие как алюминий и магний, обладают низкой плотностью и низкой температурой плавления. Они обычно более реактивны и менее стойкие к окислению, чем тяжелые металлы. Тяжелые металлы, такие как железо и свинец, имеют высокую плотность и высокую температуру плавления. Они обычно более стабильны и менее реактивны, чем легкие металлы.
Другой способ классификации металлов - это их позиция в периодической таблице химических элементов. Верхняя часть таблицы содержит щелочные металлы, такие как литий и натрий, которые обладают низкими плотностью и низкой температурой плавления. В середине таблицы находятся переходные металлы, такие как железо и медь, которые характеризуются высокой плотностью и высокой химической активностью. Внизу таблицы расположены блоки металлов-представителей, такие как алюминий и олово, которые обладают средней плотностью и средней температурой плавления.
Также металлы можно классифицировать по их использованию. Некоторые металлы, такие как железо и сталь, широко используются в строительстве и производстве машин, благодаря своей прочности и устойчивости к коррозии. Другие металлы, например алюминий и медь, используются в производстве электрических проводов и аппаратов, так как они обладают хорошей электропроводностью. Еще другие металлы, например золото и серебро, используются для изготовления ювелирных украшений и монет из-за своей привлекательности и редкости.
В целом, металлы играют важную роль в химических реакциях и имеют множество различных свойств и применений. Их классификация позволяет лучше понять и организовать изучение и использование этих веществ.
Физические свойства металлов: проводимость и теплоемкость
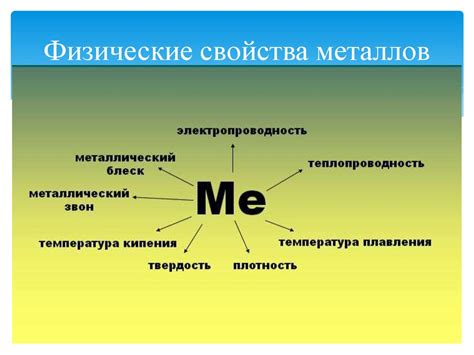
Металлы обладают рядом уникальных физических свойств, которые делают их неотъемлемой частью современной промышленности и технологий. Одной из таких свойств является высокая проводимость электричества. Металлы, такие как медь, алюминий и железо, обладают способностью передавать электрический ток практически без потерь. Это делает их незаменимыми материалами для производства проводов, кабелей, электроники и других электротехнических устройств.
Кроме того, металлы также обладают высокой теплоемкостью. Это означает, что они способны поглощать и отдавать тепло с большой эффективностью. Поэтому металлы широко используются в производстве теплообменных аппаратов, таких как радиаторы и теплообменники, которые применяются в системах отопления и кондиционирования воздуха.
Кроме того, некоторые металлы, такие как алюминий и медь, обладают высокой теплопроводностью. Это означает, что они способны передавать тепло с высокой скоростью. Такие металлы применяются в производстве кастрюль, сковородок и другой посуды для быстрого и равномерного распределения тепла при готовке.
В целом, физические свойства металлов, такие как проводимость и теплоемкость, позволяют им выполнять ряд важных функций и играть важную роль в множестве химических реакций и процессов. Без металлов, современный мир был бы невозможен. Их уникальные свойства делают их незаменимыми материалами для различных промышленных и научно-исследовательских областей.
Химические свойства металлов: реакция с кислородом и кислотами
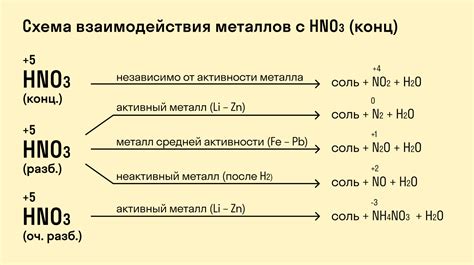
Реакция металлов с кислородом: В результате взаимодействия металлов с кислородом возникают оксиды металлов. Эта реакция, известная как окисление металлов, является одной из основных химических свойств металлов. Оксиды металлов имеют различные свойства и важны в различных областях, таких как производство стекла, керамики и различных видов металлургии.
Реакция металлов с кислотами: Металлы могут реагировать с кислотами, образуя соли и выделяя водород. Эта реакция является примером дисплейсментной реакции, когда металл вытесняет водород из кислоты. Например, реакция железа с соляной кислотой приводит к образованию соли железа (железохлорида) и выделению водорода.
Свойства оксидов металлов: Оксиды металлов обладают различными химическими и физическими свойствами в зависимости от металла и его окисления. Некоторые оксиды металлов, такие как оксид алюминия, обладают высокой термической и электрической проводимостью, что делает их полезными для производства электроники. Другие оксиды, такие как оксид железа, являются основными компонентами окрашенных пигментов и катализаторов.
Химические свойства металлов, такие как их реакция с кислородом и кислотами, играют важную роль в различных сферах человеческой деятельности, начиная от производства материалов и электроники, до использования металлов в медицине и энергетике.
Коррозия металлов: процесс и способы защиты

Коррозия металлов — это процесс разрушения металлической поверхности под воздействием внешних факторов, таких как кислород, влага, соли и другие химические соединения. Коррозия является одной из основных проблем, с которой сталкиваются использованные в промышленности и повседневной жизни изделия из металла.
Одним из способов защиты металлов от коррозии является создание защитной пленки на их поверхности. Для этого используются различные методы, такие как нанесение оксидных пленок, гальваническое покрытие и электропластическая обработка. Защита металлов может также осуществляться путем нанесения защитных покрытий, содержащих полимерные материалы, которые препятствуют проникновению вредных веществ.
Кроме того, существуют методы активной и пассивной защиты металлов от коррозии. Активная защита основана на использовании анодов, которые радикально замедляют процесс окисления металла. Пассивная защита достигается путем образования пассивной пленки на поверхности металла, которая препятствует дальнейшей коррозии.
- Благодаря активному и органическому подходу к защите металлов, удалось значительно снизить уровень коррозии в различных областях применения металлических изделий. Это особенно важно в автомобильной, аэрокосмической и строительной отраслях.
- Современные технологии защиты металлов также ориентированы на повышение эффективности, экономичность и экологичность процессов обработки.
- Итак, защита металлов от коррозии играет важную роль в поддержании и продлении срока службы металлических изделий. Развитие защитных технологий и постоянное совершенствование материалов позволяют улучшить качество и надежность изделий, а также значительно снизить затраты на их ремонт и замену.
Металлы в редокс-реакциях: сокращение и окисление

Металлы играют важную роль в химических реакциях, особенно в реакциях окисления и восстановления, которые называют редокс-реакциями. Редокс-реакции основаны на передаче электронов между взаимодействующими веществами. В этих реакциях металлы могут проявлять свои характеристические свойства, такие как способность сокращаться и окисляться.
Сокращение – это процесс, при котором металл теряет электроны и уходит в более низкую степень окисления. В результате сокращения возникает положительный ион металла, который имеет меньшее количество электронов, чем в исходном состоянии. Например, если медь Cu^2+ окисляется до меди Cu^+, это означает, что медь потеряла один электрон и сократилась.
Окисление – это процесс, при котором металл получает электроны и уходит в более высокую степень окисления. В результате окисления возникает отрицательный ион металла, который имеет большее количество электронов, чем в исходном состоянии. Например, если железо Fe^2+ окисляется до железа Fe^3+, это означает, что железо получило один электрон и окислилось.
Металлы могут играть различные роли в редокс-реакциях. Они могут служить источником электронов при окислении (восстановление), а также принимать электроны при сокращении (окисление). Эти реакции часто происходят в присутствии кислорода или других окислителей, которые обеспечивают электронную передачу между металлом и другими веществами. В результате таких реакций возникают различные соединения металла с окислителем или восстановителем.
Легирование металлов: улучшение свойств и применение

Легирование – важный процесс в металлургии, который заключается в добавлении к основному металлу малых долей других элементов – легирующих добавок. Этот процесс имеет целью улучшение свойств основного металла и придание ему необходимых химических и физических характеристик.
Одним из основных преимуществ легирования металлов является возможность улучшить их прочность, твердость и устойчивость к коррозии. В зависимости от того, какие элементы используются в качестве легирующих добавок, можно достичь различных свойств металла. Например, добавление хрома при легировании стали позволяет повысить ее стойкость к окислительной коррозии.
Легирование металлов также позволяет изменять их электрические и магнитные свойства. Например, добавление алюминия к меди при производстве электрических проводов позволяет увеличить их электропроводность и снизить потери энергии при передаче.
Применение легированных металлов в различных отраслях промышленности широко распространено. Легирование алюминия и его сплавов позволяет создавать легкие и прочные конструкции в авиационной и автомобильной промышленности. Легирование железа позволяет получить стали разной степени твердости и прочности, что находит применение в строительстве и машиностроении.
В заключение, легирование металлов является важным процессом, который позволяет улучшить свойства основного металла и придать ему необходимые характеристики для различных промышленных целей. Благодаря легированию, металлы приобретают новые свойства, что расширяет их область применения в различных отраслях промышленности.
Роль металлов в промышленных и химических процессах

Металлы играют важную роль в промышленных и химических процессах благодаря своим уникальным физическим и химическим свойствам. Например, металлы часто используются в качестве катализаторов при проведении различных химических реакций, таких как гидрогенизация, окисление и гидратация. Катализаторы помогают ускорить реакцию, увеличивая скорость образования продуктов и снижая активационную энергию.
Кроме того, металлы широко применяются в процессе электролиза, который играет важную роль в производстве металлических изделий. Электролиз позволяет разделить соединения металлов на их основные составляющие, что позволяет получать чистые металлы с высокой степенью чистоты и нужными характеристиками.
Также металлы активно используются в производствах стали, алюминия и других материалов. Например, железо и его сплавы широко применяются в строительстве, машиностроении и автомобильной промышленности благодаря своей прочности и устойчивости к коррозии. Алюминий, в свою очередь, используется в производстве легких конструкций, таких как авиационные и автомобильные детали, благодаря своей низкой плотности и хорошим техническим характеристикам.
Кроме того, металлы играют важную роль в процессе энергетического производства. Например, медь используется в производстве электропроводки и электронных устройств благодаря своей высокой электропроводности. Серебро и золото также используются в электронике и технологии благодаря своим уникальным электрофизическим свойствам. Кроме того, ядерные реакции, которые используются в энергетической отрасли, также вовлекают металлы.
Экологические проблемы: использование и утилизация металлов

Металлы являются неотъемлемой частью нашей современной жизни, использование которых проникает во всех сферах нашей активности - в производстве, строительстве, энергетике, медицине и даже в повседневной жизни. Однако такое широкое применение металлов имеет свою темную сторону - экологические проблемы, связанные с их использованием и утилизацией.
Первая экологическая проблема, связанная с использованием металлов, это добыча. Добыча металлов ведется на различных шахтах и карьерах, что приводит к разрушению природных экосистем, загрязнению водных ресурсов и выделению большого количества выбросов в атмосферу. Кроме того, добыча металлов нередко связана с отравлением окружающей среды химическими веществами, такими как тяжелые металлы и кислоты.
Вторая проблема связана с производством и использованием изделий из металлов. В процессе производства металлов и изготовления из них изделий используются различные химические вещества и энергия, что приводит к большим выбросам загрязняющих веществ и потреблению энергии. Кроме того, сама эксплуатация изделий из металлов также может вредить окружающей среде - например, при использовании автомобилей, которые выбрасывают вредные вещества в атмосферу.
Третья проблема связана с утилизацией и переработкой металлов. Большое количество отходов из металлов собирается на свалках, что может приводить к их загрязнению и проникновению в почву, воду и атмосферу. Кроме того, процесс переработки и утилизации металлов также требует использования больших энергетических и финансовых ресурсов, что вносит свой вклад в экологические проблемы.
Заключение: экологические проблемы, связанные с использованием и утилизацией металлов, требуют серьезного внимания со стороны производителей, потребителей и государства. Контроль над добычей, использованием и утилизацией металлов, а также разработка новых технологий и методов, позволяющих снизить воздействие на окружающую среду, являются ключевыми аспектами решения проблемы. Ответственное отношение к использованию и утилизации металлов будет способствовать сохранению окружающей среды и здоровья человека.
Вопрос-ответ

Что такое металлы?
Металлы – это обширная группа химических элементов, которые обладают способностью проводить электрический ток и тепло. Они обладают характерными физическими свойствами, такими как блеск, хорошая термическая и электрическая проводимость, гибкость, высокая плотность и т.д.
Какие металлы считаются самыми популярными и распространенными в мире?
Самыми популярными и распространенными металлами в мире являются железо, алюминий, свинец и медь. Железо, например, активно используется в строительстве, машиностроении и производстве стали. Алюминий широко применяется в авиации, электротехнике и упаковке. Свинец применяется в аккумуляторах, а медь - в электронике, электротехнике и строительстве.
Какая роль металлов в химических реакциях?
Металлы играют важную роль в химических реакциях. Они могут быть активными агентами в реакциях окисления и восстановления. Металлы могут служить катализаторами, участвуя в ускорении химических реакций. Они также могут образовывать сложные соединения с другими элементами, что позволяет использовать металлы в различных отраслях науки и промышленности, включая фармацевтику, энергетику, металлообработку и другие.
Какие примеры химических реакций, в которых участвуют металлы?
Примерами химических реакций, в которых участвуют металлы, являются реакции горения или окисления, реакции образования солей при взаимодействии кислот с металлами, реакции обесцвечивания или окрашивания различных веществ при взаимодействии с соответствующим металлом, реакции каталитического окисления и восстановления, реакции образования сплавов и т.д.
