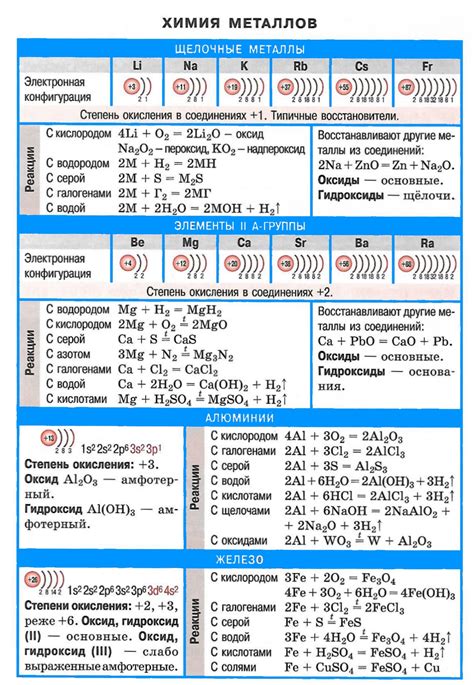
Щелочные металлы относятся к первой группе элементов периодической системы Менделеева. Они включают в себя литий, натрий, калий, рубидий, цезий и франций. Одной из особенностей щелочных металлов является их низкая плотность и мягкость.
Литий, самый легкий из щелочных металлов, представляет собой серебристо-белый металл, который легко режется ножницами. Натрий также серебристого цвета, хорошо проводит электричество и тепло, является важным элементом для поддержания жизни организмов. Калий имеет сходные свойства с натрием, но является более реактивным элементом. Рубидий и цезий отличаются от других щелочных металлов более низкой реактивностью и более высокой плотностью.
Самым редким и радиоактивным элементом в группе щелочных металлов является франций. Он имеет самую низкую плотность и наиболее высокую радиоактивность из всех познанных элементов. Франций синтезируется только в небольших количествах и его химические свойства плохо изучены.
Одним из основных свойств щелочных металлов является их высокая реактивность с водой и кислородом. Они легко реагируют с водой, образуя щелочные растворы и выделяя водород. Реактивность экспоненциально возрастает с увеличением атомного номера в группе. Одной из наиболее известных реакций щелочных металлов с кислородом является образование оксидов и пероксидов.
Другим важным свойством щелочных металлов является их способность образовывать ионы с положительным зарядом. Они легко отдают один электрон и образуют ионы М+. Это свойство делает их хорошими катионами и участниками химических реакций. Ионы щелочных металлов широко используются в различных областях науки и технологий, включая производство стекла, лекарств и промышленных катализаторов.
В целом, свойства щелочных металлов делают их важными элементами в химической промышленности и медицине. Их низкая плотность, мягкость, реактивность и способность образовывать ионы открывают широкие возможности для их использования в различных областях науки и технологий.
Свойства щелочных металлов: описание, применение, химические свойства
Щелочные металлы - это группа элементов, включающая литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они обладают рядом уникальных свойств, которые часто используются в различных областях науки и промышленности.
Одной из главных особенностей щелочных металлов является их реактивность. Они очень химически активны и быстро вступают во взаимодействие с кислородом воздуха и водой. В результате таких реакций образуются оксиды либо гидроксиды, которые являются щелочными соединениями.
Щелочные металлы обладают высокой электропроводностью и низкой температурой плавления. Они отличаются мягкостью и можно нарезать ножом. Кроме того, у них низкая плотность, что делает их легкими и удобными в использовании. Благодаря этим свойствам, щелочные металлы часто используются в производстве аккумуляторов, сплавов и специальных стекол.
Некоторые щелочные металлы также обладают способностью образовывать стабильные соли, которые используются в различных областях, таких как медицина, пищевая промышленность и производство удобрений. Например, гидроксид натрия (NaOH), известный как сода, широко применяется в химической промышленности и бытовых условиях. Кроме того, щелочные металлы играют важную роль в ядерной энергетике, так как они используются в качестве охлаждающего вещества в ядерных реакторах.
В заключение, щелочные металлы представляют собой важную группу элементов с уникальными химическими, физическими и промышленными свойствами. Их реактивность, низкая плотность и высокая электропроводность делают их ценными материалами в различных областях применения, включая энергетику, химическую промышленность и медицину.
Щелочные металлы - что это такое?
Щелочные металлы - это группа химических элементов, которые находятся в первой группе периодической системы.
К единой группе объектов под названием "щелочные металлы" относятся такие элементы, как литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Основными свойствами щелочных металлов являются: низкая плотность, мягкость, низкая плавкость и кипение, хорошая теплопроводность и электропроводность.
Щелочные металлы обладают химической активностью и легко реагируют с водой и кислородом. Они образуют ионные соединения, обладающие высокой степенью растворимости в воде.
Химическая активность щелочных металлов становится причиной их широкого применения в различных областях, включая производство стекла, фармацевтику, батареи и многое другое.
Физические свойства щелочных металлов

Щелочные металлы - это элементы, которые находятся в первой группе периодической таблицы: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они обладают рядом физических свойств, которые делают их отличными от других элементов.
Первым заметным свойством щелочных металлов является их мягкость. Они можно разрезать ножом или даже согнуть руками. Мягкость объясняется слабостью связей между атомами в их кристаллической решетке.
Щелочные металлы имеют низкую плотность, что означает, что они легче, чем большинство других металлов. Например, литий имеет наименьшую плотность из всех металлов. Это свойство делает их хорошими материалами для использования в лёгких конструкциях и аэрокосмической промышленности.
Щелочные металлы также обладают низкой температурой плавления. Натрий, калий и рубидий могут плавиться при обычных комнатных температурах, а цезий и франций даже при немного ниже нуля по Цельсию. Это позволяет им использоваться в многих технологических процессах, включая производство стекла и процессы охлаждения в ядерных реакторах.
Химические свойства щелочных металлов

Щелочные металлы - это элементы первой группы периодической таблицы. Они включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). У этих металлов есть ряд химических свойств, которые делают их отличными от других элементов.
Первым свойством щелочных металлов является их способность активно реагировать с водой. При взаимодействии с водой щелочные металлы образуют щелочные гидроксиды и выделяются водород. Эта реакция является сильно экзотермической и может быть взрывоопасной.
Еще одним важным химическим свойством щелочных металлов является их реактивность с кислородом. При взаимодействии с кислородом они образуют оксиды, которые обладают щелочными свойствами и, таким образом, способны растворяться в воде.
Щелочные металлы также обладают высокой электроотрицательностью, что делает их хорошими элементами для образования ионных соединений. Они образуют катионы с однозначным положительным зарядом, что делает их очень реактивными и способными к образованию стабильных соединений с отрицательно заряженными ионами.
Другим важным химическим свойством щелочных металлов является их способность образовывать сплавы с другими металлами. Эти сплавы могут обладать уникальными физическими и химическими свойствами, что делает их полезными в различных промышленных процессах и технологиях.
Реакции щелочных металлов с другими элементами и веществами
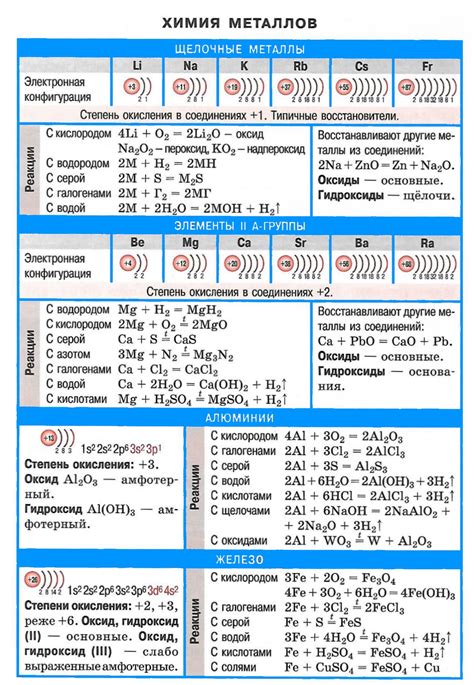
Щелочные металлы, такие как литий, натрий и калий, обладают высокой химической реактивностью и активностью. Они легко вступают в реакции с различными элементами и веществами, проявляя свои особенные свойства.
При контакте с кислородом щелочные металлы образуют оксиды, такие как оксид лития (Li2O), оксид натрия (Na2O) и оксид калия (K2O). Эти оксиды обладают щелочными свойствами и реагируют с водой, образуя гидроксиды.
С водой щелочные металлы также реагируют, образуя гидроксиды. Например, литий реагирует с водой, образуя гидроксид лития (LiOH) и выделяя водород. Натрий и калий также образуют соответствующие гидроксиды (NaOH и KOH).
Щелочные металлы реагируют с галогенами, образуя соли. Например, натрий реагирует с хлором, образуя хлорид натрия (NaCl). Калий также образует галогениды с хлором, бромом и йодом, такие как бромид калия (KBr) и иодид калия (KI).
Щелочные металлы также реагируют с аммиаком, образуя амиды. Например, натрий реагирует с аммиаком, образуя амид натрия (NaNH2). Эти амиды могут быть использованы в качестве источников аммиака в различных химических процессах.
Применение щелочных металлов в промышленности

Щелочные металлы, такие как литий, натрий и калий, обладают широким спектром применений в различных отраслях промышленности.
Литий находит применение в производстве аккумуляторов, в особенности для мобильных устройств и электромобилей, благодаря своей высокой энергетической плотности. Он также используется в производстве стекла, керамики, литиевых сплавов, промышленных смазок и синтетических полимеров.
Натрий широко применяется в химической промышленности. С его помощью производят соду, хлор и щелочное омыление. Натрий также используется в производстве стекла, мыла и моющих средств, а также в качестве реагента в различных химических реакциях.
Калий является необходимым питательным элементом для растений и широко используется в сельском хозяйстве для производства удобрений. Он также находит применение в производстве стекла, мыла, керамики и в процессе очистки нефти.
Кроме того, щелочные металлы играют важную роль в промышленности ядерной энергетики. Натрий используется в качестве охлаждающей среды в реакторах и является ключевым компонентом в процессе ядерной реакции. Калий также может использоваться в некоторых типах ядерных реакторов.
В целом, щелочные металлы имеют широкий спектр применений в промышленности и являются важными компонентами в различных производственных процессах. Их уникальные свойства делают их незаменимыми во многих отраслях и способствуют развитию технологий и инноваций.
Особенности взаимодействия щелочных металлов с водой

Щелочные металлы (например, натрий, калий, литий) имеют высокую реактивность, особенно в отношении воды. Взаимодействие щелочных металлов с водой происходит с выделением гидрогена и образованием гидроксидов.
Натрий реагирует с водой очень живо, и реакция сопровождается образованием натрия гидроксида и выделением водорода. Реакция данного щелочного металла с водой является очень быстрой и сильно эндотермической.
Калий также очень быстро реагирует с водой, в результате образуется калий гидроксид и выделяется водород. При этом реакция сопровождается появлением множества огненных искр и бурного зажигания водорода.
Литий менее реактивен, чем натрий и калий, однако он всё равно образует гидроксид лития и выделяет водород при контакте с водой. Реакция протекает менее активно, потому что литий покрыт стабильной оксидной пленкой.
В результате взаимодействия щелочных металлов с водой, образуется гидроксид металла, который в свою очередь является сильной щелочью. Гидроксиды этих металлов обладают свойствами легко растворимых веществ, способных образовывать основные растворы.
Вопрос-ответ

Что такое щелочные металлы?
Щелочные металлы - это группа элементов периодической таблицы, которые находятся в первой группе и включают в себя литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Какие свойства присущи щелочным металлам?
Щелочные металлы имеют несколько характеристических свойств. Они очень реактивны, легко окисляются воздухом, растворяются в воде, образуя щелочные растворы, обладают металлическим блеском и имеют низкую плотность и температуру плавления. Они также обладают высокой электропроводностью и способностью образовывать ионы с положительным зарядом.
