Щелочные металлы - это элементы в периодической системе химических элементов, которые находятся в первой группе. Они включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Щелочные металлы являются одними из самых реактивных металлов в присутствии воздуха и воды, и они имеют широкий спектр применений в различных областях.
У щелочных металлов есть несколько характеристических свойств. Они очень мягкие и легко отрываются от кусков, имеют низкую плотность и низкую температуру плавления. Кроме того, они имеют низкие значения термической и электрической проводимости, что делает их отличным выбором для создания аккумуляторов и других электрических устройств.
Их светло-серый металлический блеск делает их привлекательными для использования в ювелирных изделиях и декоративных изделиях. Кроме того, щелочные металлы используются в производстве стекла, взрывчатых веществ, солнечных элементов и ядерных реакторов. Их соединения также широко используются в жизни людей, например, для приготовления лекарств, косметики и жидкостей для чистки.
В целом, щелочные металлы имеют важное значение в нашей жизни и играют огромную роль в различных отраслях и областях. Их уникальные свойства и реакционная способность делают их незаменимыми во многих процессах и приложениях. Они продолжают привлекать внимание исследователей и промышленности, которые ищут новые способы использования этих металлов и их соединений.
Щелочные металлы: основные характеристики, строение и варианты использования
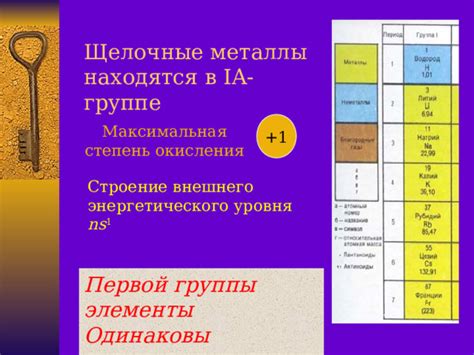
Щелочные металлы - это элементы группы 1 (IA) периодической системы Менделеева. Они включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Все они относятся к алькальным металлам и обладают сильным щелочным свойством.
Строение щелочных металлов характеризуется наличием одного внешнего электрона в своей электронной оболочке. Из-за этого они имеют высокую электроотрицательность и активность. В природе они обычно не встречаются в свободном состоянии, так как очень реакционны и легко соединяются с другими элементами.
Одной из основных характеристик щелочных металлов является низкая плотность. Литий, например, является самым легким из всех металлов. Они также обладают низкой температурой плавления и высокой электропроводностью. Можно отметить, что у них также есть высокая химическая реакционность и способность образовывать сильные основания.
Варианты использования щелочных металлов очень разнообразны. Литий используется в производстве аккумуляторов, пиротехники и лекарственных препаратов. Натрий находит применение в производстве пищевых добавок и лекарств, а также в жидком стекле. Калий используется в удобрениях, производстве взрывчатых веществ и в процессе очистки металлов. Рубидий и цезий применяются в научных исследованиях, производстве лазеров и в электронике.
В целом, щелочные металлы имеют важное значение во многих отраслях промышленности и научных исследованиях. Их уникальные свойства и химическая реакционность делают их незаменимыми во многих технологических и научных процессах.
Принципы щелочных металлов: атомная структура и свойства
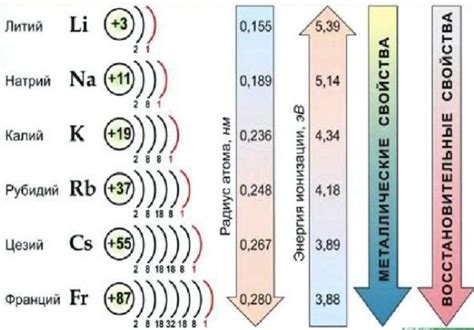
Щелочные металлы представляют собой группу химических элементов, которые находятся в первой группе периодической таблицы. Эти элементы, включающие литий, натрий, калий, рубидий, цезий и франций, обладают некоторыми общими свойствами из-за своей атомной структуры.
Атомы щелочных металлов имеют один электрон в своей внешней электронной оболочке, что делает их очень реактивными и склонными образовывать положительные ионы. Этот электрон в крайней оболочке находится далеко от положительно заряженного ядра и легко отделяется, обусловливая способность щелочных металлов к образованию ионов с зарядом +1.
Одним из основных свойств щелочных металлов является их высокая реактивность с водой и кислородом. При контакте с водой щелочные металлы образуют гидроксиды, а также высвобождаются водород и большое количество тепла. Взаимодействие с кислородом приводит к образованию оксидов щелочных металлов, которые обладают базичными свойствами.
Щелочные металлы также обладают высокой электропроводностью, что делает их полезными в различных областях, например, в электронике. Они также используются в производстве стекла, пиротехнических изделий, щелочных аккумуляторов и других изделий и материалов.
Химические свойства и реакции щелочных металлов
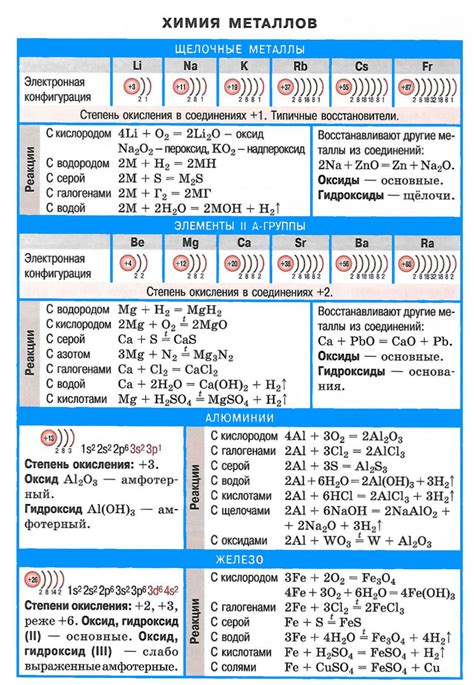
Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, обладают рядом особенных химических свойств и проявляют характерные реакции.
Во-первых, щелочные металлы являются очень реактивными. Они легко связываются с другими элементами, особенно с галогенами, такими как хлор, бром и йод, образуя щелочные металлические соли. Это проявляется, например, в реакции натрия с хлором, при которой образуется хлорид натрия - обычная поваренная соль.
Во-вторых, щелочные металлы очень активно взаимодействуют с водой. Реакция щелочного металла с водой приводит к образованию щелочной гидроксидной соли и выделению водорода. Например, реакция калия с водой протекает весьма ярко, с выделением пламени и образованием гидроксида калия.
Кроме того, щелочные металлы обладают способностью к образованию сплавов с другими металлами. Например, амальгама натрия - сплав натрия с ртутью - широко используется в различных радиоэлектронных устройствах.
Также щелочные металлы способны образовывать растворимые соединения с кислотами и многими неорганическими веществами. Это свойство часто используется в химической промышленности и лабораторных исследованиях.
Таким образом, химические свойства щелочных металлов представляют собой интересную особенность, которая позволяет использовать эти элементы в различных областях науки и техники.
Применение щелочных металлов в промышленности и научных исследованиях
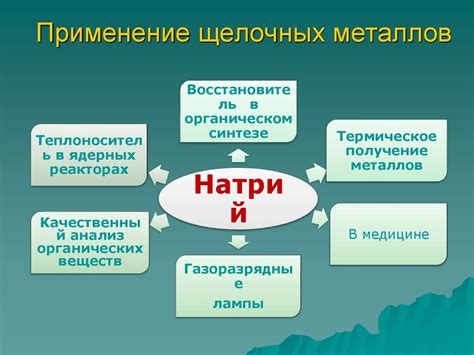
1. Производство щелочей: Щелочные металлы, такие как натрий и калий, являются основными сырьевыми материалами для производства щелочей. Щелочи широко используются в различных отраслях промышленности, включая производство стекла, мыла, очистку воды, аккумуляторов и многих других товаров и услуг.
2. Электролитические процессы: Щелочные металлы часто используются в электролитических процессах. Например, натрий используется в процессе электролиза для производства щелочей и алюминия. Калий также находит широкое применение в процессах электролиза, особенно в производстве удобрений.
3. Катализаторы и реактивы: Щелочные металлы, такие как литий и калий, часто используются как катализаторы в различных химических реакциях. Они способны активировать разные типы реакций и повышать их скорость. Это делает их незаменимыми ингредиентами в процессах синтеза различных органических и неорганических соединений.
4. Вечные батареи и аккумуляторы: Щелочные металлы, такие как литий, являются ключевыми компонентами в производстве литий-ионных аккумуляторов, которые широко используются в портативных электронных устройствах, электромобилях и других сферах. Литиевые аккумуляторы обладают высокой энергоемкостью и долгим сроком службы, что делает их востребованными в современной промышленности.
5. Научные исследования: Щелочные металлы также находят широкое применение в научных исследованиях. Например, натрий и калий используются в лабораториях для настройки анализаторов масс-спектрометров и ядерных магнитных резонансов. Это важные методы анализа, которые помогают ученым изучать химическую структуру различных веществ и понимать их свойства и взаимодействия.
Вопрос-ответ

Что такое щелочные металлы?
Щелочные металлы - это группа элементов периодической таблицы, которая включает в себя литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они отличаются высокой химической реактивностью и легко образуют ионные соединения с другими элементами.
Какие свойства характеризуют щелочные металлы?
Щелочные металлы обладают несколькими характеристиками, включая низкую плотность, низкую температуру плавления, низкую температуру кипения и высокую электроотрицательность. Они также являются хорошими проводниками электричества и тепла и обладают металлическим блеском.
Где можно найти щелочные металлы в природе?
Щелочные металлы в природе встречаются в различных минералах, солевых отложениях и горных породах. Они также могут быть обнаружены в морской воде и некоторых растениях. Например, натрий встречается в большом количестве в морской воде и хлориде натрия (поваренная соль), а калий содержится в растениях.
Как используются щелочные металлы в промышленности?
Щелочные металлы имеют широкий спектр промышленных применений. Например, натрий используется в производстве стекла, мыла и щелочей. Калий применяется в сельском хозяйстве в качестве удобрения. Рубидий используется в научных исследованиях, а литий - в производстве легких аккумуляторов.
Какие опасности существуют при работе с щелочными металлами?
При работе с щелочными металлами необходимо соблюдать осторожность, так как они очень реактивны и могут вызывать ожоги на коже и в глазах. Кроме того, щелочные металлы могут взрываться в контакте с водой или взаимодействием с некоторыми веществами. Поэтому при использовании щелочных металлов необходимо соблюдать соответствующие меры безопасности, включая использование защитной экипировки и проведение работ в хорошо проветриваемых помещениях.
