Электрохимическая коррозия - это процесс разрушения металлов, вызванный химическими реакциями с окружающей средой. Взаимодействие металла с окислителем и выделение электрической энергии в результате реакций приводит к образованию коррозионных продуктов и разрушению материала.
Одним из фундаментальных причин электрохимической коррозии является наличие электрической проводимости в окружающей среде. Она позволяет передавать электроны от одного металла к другому, что активирует химическую реакцию между металлом и окислителем. Под действием электрических потенциалов происходит процесс окисления и выделение ионов металла, что приводит к образованию коррозионных продуктов и разрушению металла.
Существуют различные методы защиты металлов от электрохимической коррозии. Одним из них является использование покрытий, которые создают преграду между металлом и окружающей средой. Такие покрытия могут быть органическими, например, краской или эмалью, либо металлическими, например, покрытием из цинка или хрома. Они уменьшают контакт металла с окислителем, предотвращая коррозию.
Другим методом является использование анодной или катодной защиты. При анодной защите на металл наносится слой, называемый анодом, который имеет более высокий потенциал электродной окислительной реакции. Это позволяет свести к минимуму реакцию коррозии, так как анодом будет слой покрытия, а не сам металл. При катодной защите наоборот металл превращается в катод, снижая его склонность к коррозии.
Также важно контролировать окислительную среду, в которой находится металл. С помощью добавления ингибиторов коррозии в окружающую среду можно уменьшить скорость реакции и предотвратить разрушение материала. Ингибиторы могут быть органическими или неорганическими веществами, которые образуют защитную пленку на поверхности металла, предотвращая его взаимодействие с окислителем.
Электрохимическая коррозия металлов

Электрохимическая коррозия - это процесс разрушения металлов, вызванный химическими реакциями взаимодействия металла с окружающей средой. Основным механизмом электрохимической коррозии является окислительно-восстановительные процессы, которые происходят на поверхности металла.
Коррозия металлов может привести к серьезным последствиям, таким как утрата прочности и стабильности конструкций, повреждение оборудования и инфраструктуры. Поэтому важно применять методы защиты от коррозии для сохранения конструкций и продления их срока службы.
Одним из методов защиты от электрохимической коррозии является использование антикоррозионных покрытий. Эти покрытия создают защитную барьерную пленку на поверхности металла, предотвращая контакт металла с окружающей средой. Некоторые покрытия также содержат ингибиторы коррозии, которые замедляют процесс окисления металла.
Еще одним методом защиты от коррозии является кафельный метод холодного сваривания. При этом методе, специальная кафельная смесь наносится на поверхность металла и быстро затвердевает, создавая защитную покрышку. Этот метод особенно эффективен для мест с повышенной влажностью и агрессивной средой.
Также широко применяются катодная защита и анодная защита. Катодная защита заключается в подключении катода к металлическому объекту, что позволяет контролировать потенциал поверхности и предотвращать коррозию. Анодная защита, напротив, осуществляется подключением анода, который жертвенно окисляется вместо защищаемого металлического объекта.
Природа электрохимической коррозии

Электрохимическая коррозия является одним из наиболее распространенных процессов разрушения металлов. Она основана на электрохимическом взаимодействии металла с окружающей средой. Коррозия возникает как результат окисления металла под влиянием кислорода, влаги и различных химических соединений.
Процесс электрохимической коррозии состоит из двух основных полу-реакций: окисления металла и восстановления вещества, присутствующего в окружающей среде. Окисление металла происходит на аноде, где металл отдает электроны и переходит в ионное состояние. Восстановление вещества происходит на катоде, где электроны, перенесенные с анода, используются для восстановления вещества.
Окислительные и восстановительные полу-реакции происходят на разных участках металла, однако они связаны электролитическим проводником, через который происходит перемещение электронов. При этом происходит формирование гальванической пары, в результате чего на аноде металла происходит электрохимическое разрушение, а на катоде происходит осаждение продуктов коррозии.
Существует несколько факторов, которые влияют на скорость электрохимической коррозии. Одним из них является разность потенциалов между анодом и катодом, которая зависит от электрохимических свойств металла и окружающей среды. Другим фактором является концентрация окислителя, который участвует в окислительной полу-реакции.
Для защиты металлов от электрохимической коррозии можно использовать различные методы, такие как анодная защита, катодная защита, покрытия и использование ингибиторов коррозии. Каждый из этих методов направлен на снижение степени окисления металла и увеличение его сопротивления коррозии.
Методы защиты от электрохимической коррозии металлов
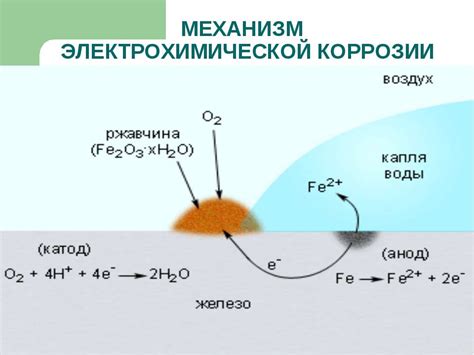
Электрохимическая коррозия является одной из основных проблем, которую необходимо решать при эксплуатации металлических конструкций и устройств. Для защиты от коррозии применяются различные методы, которые позволяют предотвратить или замедлить процесс разрушения металла.
Один из распространенных методов защиты от коррозии - использование защитных покрытий. Покрытие наносится на поверхность металла, создавая барьер, который защищает его от контакта с агрессивной средой. Такие покрытия могут быть органического или неорганического происхождения и могут быть нанесены методом покраски, гальваники или термического напыления.
Еще одним методом защиты от электрохимической коррозии является использование анодной защиты. При этом на металлическую конструкцию наносятся специально подобранные аноды, которые компенсируют потерю электронов металлом и предотвращают его коррозию. Анодную защиту применяют в основном для подводных или затопленных строений, таких как нефтепроводы или пирсы.
Также существует метод катодной защиты, при котором на металлическую конструкцию подают электрический ток, который делает ее катодом. В результате применения этого метода, процесс коррозии замедляется или полностью прекращается. Катодную защиту применяют при эксплуатации подземных трубопроводов, резервуаров и других объектов с контактом с почвой или влажной средой.
Ингибиторы коррозии

Ингибиторы коррозии — это химические соединения, добавляемые в среду, чтобы предотвратить или замедлить процесс коррозии металлов. Ингибиторы коррозии обладают способностью взаимодействовать с поверхностью металла и образовывать защитную пленку, которая предотвращает контакт металла с агрессивной средой.
Ингибиторы коррозии можно разделить на органические и неорганические. Органические ингибиторы обычно являются нежелательными продуктами окисления и проявляются как пленка на поверхности металла. Они адсорбируются или проникают в пленку оксида и замедляют анодную или катодную реакцию. Неорганические ингибиторы, такие как хроматы, азот и фосфор, образуют несмываемую пленку на поверхности металла.
Ингибиторы коррозии используются в различных отраслях промышленности, включая нефтегазовую, химическую и электроэнергетическую. Они могут быть добавлены в среду в виде жидкостей, порошков или пленок, а также использоваться в качестве покрытий или покрытых металлических материалов.
Определение эффективности ингибиторов коррозии включает оценку их стойкости к агрессивной среде, адсорбции на поверхности металла, способности образовывать защитную пленку и снижать скорость коррозии. Выбор ингибитора и его концентрация зависят от типа металла, условий эксплуатации и требований к долговечности защиты от коррозии.
Вопрос-ответ

Что такое электрохимическая коррозия металлов?
Электрохимическая коррозия металлов – это процесс разрушения металлической поверхности под воздействием химических реакций, происходящих в присутствии электролита (например, влажного воздуха или воды).
Какими факторами может быть вызвана электрохимическая коррозия металлов?
Факторами, вызывающими электрохимическую коррозию металлов, могут быть влажность, кислотность или щелочность среды, наличие растворенных солей, разница в потенциалах между различными частями металла, наличие катодов и анодов, наличие микротрещин в металле.
Какие методы защиты от электрохимической коррозии металлов существуют?
Существует несколько методов защиты от электрохимической коррозии металлов. Один из них – использование покрытий на поверхности металла, например, лаков, эмалей или специальных антикоррозионных покрытий. Другой метод – катодная защита, при которой металл подключается к отрицательному полюсу источника постоянного тока. Еще одним методом является применение антикоррозионных добавок, которые предотвращают развитие коррозионных процессов.
Каким образом формируются антикоррозионные покрытия на металле?
Антикоррозионные покрытия на металле образуются за счет нанесения специальных составов на поверхность металла, которые после высыхания образуют плотную и прочную пленку. Эта пленка защищает металл от воздействия влаги и других агрессивных сред.
