Электроотрицательность - это свойство атомов притягивать электроны в химической связи. Этот показатель играет важную роль при анализе химической активности различных элементов. Металлы и неметаллы имеют разные степени электроотрицательности, что влияет на их взаимодействие друг с другом и способность образовывать химические соединения.
Металлы обычно имеют меньшую электроотрицательность по сравнению с неметаллами. Это связано с тем, что металлы обладают меньшей способностью притягивать электроны. В результате этого, металлы часто отдают свои электроны в химических реакциях, образуя положительно заряженные ионы. Это делает металлы хорошими проводниками электричества и тепла.
С другой стороны, неметаллы обладают большей электроотрицательностью. Они сильнее притягивают электроны и образуют отрицательно заряженные ионы или делят электроны с другими атомами. Из-за этого неметаллы обычно не обладают хорошей электропроводностью и в большинстве случаев не являются хорошими теплопроводниками.
Электроотрицательность: какой элемент имеет больше - металл или неметалл?

Электроотрицательность является одним из важных критериев для определения химических свойств элементов. Она характеризует способность атома притягивать электроны во время химической реакции.
Металлы и неметаллы отличаются величиной электроотрицательности. Обычно неметаллы имеют более высокую электроотрицательность, чем металлы. Это связано с расположением элементов в периодической таблице. Неметаллы находятся в правой части таблицы, в то время как металлы находятся в левой и средней части.
Неметаллы характеризуются высокой электроотрицательностью, так как они имеют большую силу притяжения к электронам. Это объясняет их способность к образованию ковалентных связей и положительным ионам. Электроотрицательность неметаллов также влияет на их химические свойства, такие как агрессивность, реактивность и способность образовывать кислоты.
В то же время, металлы обладают более низкой электроотрицательностью. Их атомы имеют меньшую силу притяжения к электронам, что позволяет образовывать металлические связи и положительные ионы. Металлы обычно характеризуются хорошей теплопроводностью, электропроводностью и блеском.
Таким образом, можно сказать, что неметаллы имеют большую электроотрицательность, чем металлы. Это связано с их положением в периодической таблице и способностью атомов притягивать электроны. Однако, стоит отметить, что существуют исключения, и некоторые металлы могут иметь более высокую электроотрицательность, чем некоторые неметаллы.
Что такое электроотрицательность и зачем она нужна?

Электроотрицательность - это свойство элементов химического вещества притягивать электроны во время образования химической связи. Это важная характеристика элементов, которая позволяет оценить их способность принимать или отдавать электроны в реакциях веществ.
Значение электроотрицательности определяет, как сильно элемент притягивает электроны. Чем больше значение электроотрицательности, тем сильнее элемент притягивает электроны. Электроотрицательность измеряется по шкале, созданной Линусом Полингом - шкале Полинга.
Знание электроотрицательности элементов имеет большое значение при анализе химической активности вещества. Оно помогает предсказывать, как будет происходить образование химических связей и реализация химических реакций.
Электроотрицательность также позволяет классифицировать элементы на металлы и неметаллы. Неметаллы обладают высокой электроотрицательностью, что позволяет им притягивать электроны и образовывать ковалентные связи. Металлы же имеют низкую электроотрицательность и образуют ионные связи, отдавая электроны. Эта классификация позволяет лучше понять свойства и поведение различных элементов.
Металлы - кто они такие?

Металлы - это группа химических элементов, обладающих рядом особых свойств. В основном, металлы имеют блестящую поверхность и хорошую электропроводность. Они зачастую тяжелые, твёрдые и обладают высокой плотностью.
Одной из главных особенностей металлов является их способность образовывать ионные связи с неметаллами. Поэтому металлы часто используются в химических реакциях, электротехнике и строительстве.
Металлы делятся на две основные группы: драгоценные металлы и недрагоценные металлы. Драгоценные металлы, такие как золото, серебро и платина, ценятся за свою высокую стоимость, блеск и устойчивость к коррозии. Недрагоценные металлы, например, железо, алюминий и медь, широко используются в промышленности и строительстве.
Металлы также могут быть подразделены на лёгкие металлы и тяжёлые металлы. Лёгкие металлы, такие как алюминий и магний, характеризуются низкой плотностью и хорошими свойствами легкости. Тяжёлые металлы, например, свинец и ртуть, обладают высокой плотностью и различными токсичными свойствами.
Интересно отметить, что металлы находятся слева от периодической таблицы химических элементов. Некоторые из них, такие как литий и магний, находятся на пути отсечения антиметаллов, перед которыми они имеют более неметаллические свойства, а после металлические.
Неметаллы - основные представители

Неметаллы - это вещества, которые обладают низкой электроотрицательностью по сравнению с металлами. Они имеют слабую способность отдавать электроны при химических реакциях и образуют в основном ковалентные связи.
Кислород - один из самых известных неметаллов, который обладает высокой электроотрицательностью. Он составляет около 20% атмосферы Земли и является неотъемлемой частью большинства органических веществ.
Углерод - еще один важный неметалл. Он имеет способность образовывать множество соединений благодаря своей способности образовывать четыре ковалентные связи. Углерод является основным элементом органической химии и встречается в различных формах, включая алмазы, графит и углеродные нанотрубки.
Азот - еще один распространенный неметалл, который составляет около 78% атмосферы Земли. Он обладает сильно электроотрицательностью и является важным компонентом белков и нуклеиновых кислот.
Фосфор - еще один неметалл, который играет важную роль в биологических процессах. Он является ключевым элементом в ДНК, РНК и АТФ, основных молекулах, отвечающих за наследственность и энергетические процессы в клетках.
Сера - неметалл, который широко используется в различных областях. Он присутствует во многих минералах и источниках энергии, таких как нефть и уголь. Сера также является важным компонентом для производства удобрений, пластиков и лекарственных препаратов.
В целом неметаллы - это разнообразная группа элементов, которые играют важную роль в химических и биологических процессах. Они обладают различными свойствами и используются в различных областях науки и промышленности.
Сравнение электроотрицательности металлов и неметаллов

Электроотрицательность - это важная характеристика атомов, которая характеризует их способность притягивать электроны в химической связи. Она играет важную роль в химических реакциях и определяет химические свойства веществ. Возникает вопрос: у каких элементов - металлов или неметаллов - электроотрицательность выше?
Обычно неметаллы имеют более высокую электроотрицательность по сравнению с металлами. Это связано с тем, что у неметаллов обычно больше электронов в молекуле, а также их ядро притягивает электроны сильнее, что делает их более электроотрицательными. Неметаллические элементы, такие как кислород, фтор, хлор, азот и сера, обладают высокой электроотрицательностью.
С другой стороны, металлы обычно имеют более низкую электроотрицательность. Они имеют меньшее число электронов во внешней оболочке и менее сильно притягивают электроны к своему ядру. Металлы, такие как натрий, магний, железо и алюминий, обладают низкой электроотрицательностью.
Электроотрицательность металлов и неметаллов связана с формированием ионных и ковалентных связей. Ионные связи образуются между металлами и неметаллами с высокой электроотрицательностью, тогда как ковалентные связи образуются между неметаллами с высокой электроотрицательностью.
В таблице электроотрицательности у Линуса Полинга электроотрицательности элементов отображаются числами от 0 до 4, где 0 - наименьшая, а 4 - наивысшая электроотрицательность. Используя эту таблицу, можно сравнить электроотрицательность различных элементов и определить, являются ли они металлами или неметаллами.
Зависимость электроотрицательности от периодической системы
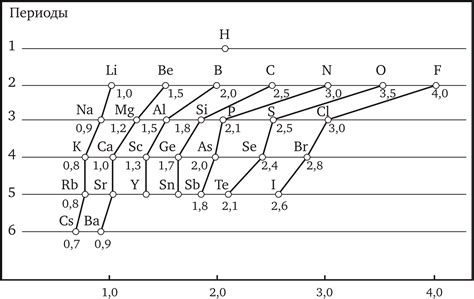
Электроотрицательность — это способность атома атома привлекать к себе электроны во время образования связи с другими атомами. Она играет важную роль в химических реакциях и свойствах веществ. Значение электроотрицательности связано с расположением элемента в периодической системе.
В периодической системе химических элементов электроотрицательность обычно возрастает от левой части таблицы к правой, а также снижается с верхней строки вниз. В группе элементов электроотрицательность увеличивается при движении к верхней строке.
Металлы обычно обладают более низкой электроотрицательностью по сравнению с неметаллами. Наибольшая электроотрицательность наблюдается у флуора, являющегося самым электроотрицательным элементом. К неметаллам с высокой электроотрицательностью относятся кислород, хлор, азот, сера.
Правильное расположение элементов в таблице Менделеева позволяет сделать общие выводы о их электроотрицательности. Например, в 2-й группе элементов электроотрицательность увеличивается по мере движения вверх по группе, так как атомы становятся меньше и имеют большую эффективность привлечения электронов.
В целом, электроотрицательность является важным свойством элементов, которое определяет их способность образовывать химические связи и влияет на их реакционную активность. Зависимость электроотрицательности от периодической системы помогает упорядочить элементы и понять их химические свойства.
Факторы, влияющие на электроотрицательность

Электроотрицательность химического элемента является характеристикой его способности привлекать электроны к себе при образовании химических связей. Различные факторы могут влиять на электроотрицательность элемента и определять его положение в периодической системе.
Атомный радиус: В целом, элементы с меньшим атомным радиусом имеют большую электроотрицательность. Маленькие атомы имеют сильное притяжение к электронам, так как их ядра находятся ближе к электронам.
Ядерный заряд: Чем больше заряд ядра, тем больше электроотрицательность элемента. Больший положительный заряд ядра притягивает электроны к себе сильнее, что делает элемент более электроотрицательным.
Электронная конфигурация: Электроотрицательность элемента также зависит от его электронной конфигурации. Наличие неполного электронного облака или открытые электронные оболочки может приводить к более высокой электроотрицательности.
Тип элементов: В общем, неметаллы имеют большую электроотрицательность по сравнению с металлами. Неметаллы более склонны к притяжению электронов и образованию ковалентных связей, в то время как металлы имеют склонность отдавать электроны и образовывать ионные связи.
Электроотрицательность в периодической системе: Электроотрицательность элементов увеличивается сверху вниз и слева направо в периодической системе. Можно заметить, что электроотрицательность возрастает от щелочных металлов к инертным газам.
В целом, электроотрицательность является важной характеристикой элементов и играет ключевую роль в понимании их химических свойств и поведения.
Применение электроотрицательности в химических реакциях

Электроотрицательность является важной характеристикой элементов, которая определяет их способность притягивать электроны в химических связях. Учитывая разницу в электроотрицательности, можно предсказать, какие элементы будут образовывать ионные связи, а какие - ковалентные.
В ионных связях один элемент, обладающий высокой электроотрицательностью, отбирает электроны у другого элемента, у которого электроотрицательность ниже. Это приводит к образованию положительно и отрицательно заряженных ионов, которые притягиваются друг к другу и образуют кристаллическую решетку. Примером может служить образование ионной связи между натрием (Na) и хлором (Cl) в соли натрия (NaCl).
В ковалентных связях электроотрицательность также играет роль. Если разница в электроотрицательности между элементами невелика, то они могут образовывать ковалентные связи, в которых электроны общаются между собой равномерно. Однако, если разница в электроотрицательности велика, то электроны в ковалентной связи будут смещены ближе к элементу с большей электроотрицательностью. Примером может служить образование ковалентной связи между кислородом (O) и водородом (H) в воде (H2O).
Кроме образования связей, электроотрицательность также играет роль в химических реакциях. Например, при замещении элементов в химических реакциях, элементы с большей электроотрицательностью могут замещать элементы с меньшей электроотрицательностью. Например, в реакции между цинком (Zn) и кислородом (O), цинк замещает водород (H) из воды (H2O), так как электроотрицательность цинка выше, чем у водорода.
Итак, электроотрицательность играет важную роль в химических реакциях и формировании химических связей. Умение анализировать электроотрицательность элементов помогает предсказывать и объяснять химические свойства и реакции веществ.
Выводы:

Изучив электроотрицательность металлов и неметаллов, можно сделать несколько заключений. Во-первых, неметаллы обладают более высокой электроотрицательностью по сравнению с металлами. Это связано с их способностью привлекать электроны к себе во время химических реакций.
Во-вторых, электроотрицательность металлов и неметаллов оказывает влияние на химические свойства веществ. Неметаллические элементы обычно образуют ковалентные связи, так как их высокая электроотрицательность позволяет им привлекать электроны и образовывать пары электронов с другими атомами. Металлы, в свою очередь, образуют металлические связи, где электроотрицательность играет меньшую роль.
В-третьих, электроотрицательность также влияет на положительный и отрицательный заряды в химических соединениях. Неметаллы обычно образуют отрицательно заряженные ионы (анионы), тогда как металлы образуют положительно заряженные ионы (катионы).
В целом, электроотрицательность является важным параметром, который помогает определить поведение элементов в химических реакциях и свойствах соединений. Она влияет на тип и силу химических связей, а также на изменение заряда в процессе образования ионов. Поэтому понимание электроотрицательности является необходимым для изучения химии и позволяет предсказывать химические свойства различных веществ.
Вопрос-ответ

Как определить электроотрицательность вещества?
Электроотрицательность вещества можно определить по его способности притягивать электроны к себе в химической связи. Обычно электроотрицательность измеряется с использованием шкалы Полинга.
Так кто же имеет большую электроотрицательность - металлы или неметаллы?
Обычно неметаллы имеют большую электроотрицательность по сравнению с металлами. Это связано с тем, что неметаллы имеют большую способность притягивать электроны в химических связях.
