Атомно кристаллическое строение металлов является одним из основных факторов, определяющих их свойства и характеристики. Металлы представляют собой кристаллические соединения, в которых атомы упорядочены по определенным правилам. Это делает металлы прочными, устойчивыми и имеющими высокую теплопроводность.
Атомы металлов образуют решетку, в которой каждый атом окружен шестью соседними атомами. Это свойство называется координационным числом и является одной из основных характеристик атомного кристаллического строения металлов. Благодаря этому свойству металлы обладают высокой пластичностью и способностью изменять свою форму без разрушения.
Еще одной важной характеристикой атомного кристаллического строения металлов является их электропроводность. Благодаря упорядоченной структуре атомов и наличию свободных электронов в зоне проводимости, металлы имеют высокую способность проводить электричество. Это делает их необходимыми материалами для создания электрических проводов и различных электронных устройств.
Кроме того, атомно кристаллическое строение металлов влияет на их механические свойства, такие как прочность и твердость. Благодаря известной структуре и прочным связям между атомами, металлы обладают высокой прочностью и способностью выдерживать большие нагрузки без деформации. Это позволяет им использоваться в конструкционных материалах и машиностроении.
Структура металлов
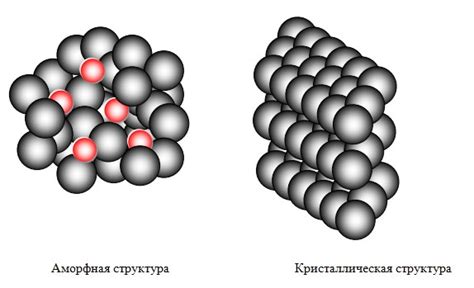
Атомно кристаллическое строение металлов является одним из основных характеристик, определяющих их свойства. Оно основано на упорядоченном расположении атомов в решетке.
Металлическая решетка представляет собой трехмерную сетку из позиций атомов, которые образуют кристаллическую структуру. Каждый атом металла находится в устойчивом положении, окруженном соседними атомами.
В металлической решетке основную роль играют свободно движущиеся электроны, которые служат связующим звеном между атомами. Они образуют "облако" электронов, которое пронизывает всю решетку.
Структура металлов влияет на их физические и химические свойства. Например, наличие свободных электронов позволяет металлам быть хорошими проводниками электричества и тепла, а также иметь специфическую металлическую блеск.
Один из важных параметров металлической структуры - плотность упаковки атомов. Она определяет, насколько компактно атомы расположены в решетке и влияет на механические свойства металлов, такие как твердость и прочность.
Атомное кристаллическое строение
Атомное кристаллическое строение - это особый тип строения, присущий металлам. Оно характеризуется упорядоченным расположением атомов в кристаллической решетке. Атомы металла образуют регулярные структуры, состоящие из повторяющихся элементарных ячеек.
Атомы металла в кристаллической решетке связаны между собой сильными металлическими связями, что придает металлам их основные физические свойства, такие как высокая термическая и электропроводность.
В атомном кристаллическом строении металлов есть различные типы решеток, такие как кубическая, гексагональная, тетрагональная и другие. Каждый тип решетки характеризуется определенными параметрами, такими как межатомное расстояние и углы между ребрами решетки.
Атомное кристаллическое строение металлов является важной особенностью, определяющей их механические, тепловые и электрические свойства. Изучение этого строения позволяет понять, какие факторы влияют на эти свойства и как можно изменять их с помощью различных методов обработки и сплавления металлов.
Кристаллическая решетка
Кристаллическая решетка является основной структурной формой атомно-кристаллического строения металлов. Она состоит из регулярных повторяющихся элементов, называемых узлами, которые связаны между собой линиями, называемыми ребрами. Каждый узел в решетке представляет собой атом или группу атомов, которые занимают фиксированное положение в пространстве.
Кристаллическая решетка металлов обладает рядом характеристик и свойств. Например, она обеспечивает металлам прочность и термическую устойчивость. Кристаллическое строение также определяет основные механические свойства металлов, такие как твердость, пластичность и упругость.
Кристаллическая решетка металлов может быть различной формы и структуры. Например, одни металлы имеют простую кубическую решетку, где каждый узел имеет по восемь соседних атомов. Другие металлы могут иметь сложную ромбическую или гексагональную решетку, где количество соседних атомов на каждом узле может быть различным.
Важным свойством кристаллической решетки металлов является наличие дефектов, таких как примеси и вакансии. Примеси могут влиять на физические и химические свойства металлов, а вакансии могут вызывать деформации решетки и изменять механические свойства металла. Поэтому изучение кристаллической решетки металлов является важной задачей в материаловедении и металлургии.
Регулярность расположения атомов

Атомно кристаллическое строение металлов характеризуется высокой степенью регулярности расположения атомов в кристаллической решетке. Внутри решетки атомы металла занимают определенные позиции и упорядоченно связаны друг с другом.
Регулярность расположения атомов обеспечивает металлам такие характеристики, как кристаллическая анисотропия, механическая прочность и электрическая проводимость. Кристаллическая анисотропия означает, что у металла свойства в разных направлениях могут различаться.
Расположение атомов в кристаллической решетке происходит по определенным правилам. В металлах преобладает простейшая типовая решетка - кубическая гранецентрированная (КГЦ) или кубическая гранецентрированная (КЦ). В этих решетках каждый угловой атом окружен 8-ю атомами, а каждый гранецентрированный атом окружен 12-ю атомами.
Другой важной характеристикой регулярного расположения атомов является размер элементарной ячейки. Размер элементарной ячейки определяется расстоянием между атомами в решетке. Наличие регулярности расположения атомов позволяет контролировать и модифицировать свойства металлов путем изменения размеров элементарной ячейки, добавления примесей и др.
Типы кристаллического строения

Кристаллическое строение металлов определяется тем, как атомы или ионы металла упорядочены в пространстве. В результате этого образуется устойчивая и регулярная структура, которая называется кристаллом. Существует несколько типов кристаллического строения металлов, которые определяют их основные характеристики и свойства.
Первый тип кристаллического строения - кубическая решетка. В данном случае атомы металла располагаются на узлах простейшей кубической решетки. Примером металла с таким кристаллическим строением является железо. Кубическая решетка характеризуется одинаковыми интератомными расстояниями по всем направлениям.
Второй тип кристаллического строения - гексагональная герениевая решетка. В данном случае атомы металла располагаются на узлах гексагональной решетки. Примером металла с таким кристаллическим строением является цирконий. Гексагональная герениевая решетка характеризуется различными интератомными расстояниями в плоскости и особенностями в вертикальном направлении.
Третий тип кристаллического строения - гранее-центрированная кубическая решетка. В данном случае атомы металла располагаются на узлах простейшей кубической решетки, а также в центре каждой грани. Примером металла с таким кристаллическим строением является вольфрам. Гранее-центрированная кубическая решетка характеризуется различными интератомными расстояниями и более сложной пространственной структурой.
Гранцентрированная кубическая решетка
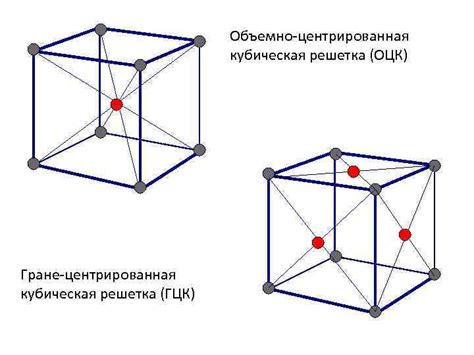
Гранцентрированная кубическая решетка (ГЦК) - одна из самых распространенных кристаллических структур металлов. В данной структуре каждый атом располагается в узлах кубической решетки, а также в центре каждого гранного гранкубооктаэдра.
ГЦК решетка обладает рядом особых характеристик. Во-первых, она обладает высокой плотностью упаковки атомов - порядка 74%. Это связано с тем, что каждый атом окружается 12-ю ближайшими соседями, что обеспечивает эффективное использование пространства.
Во-вторых, ГЦК решетка обладает высокой механической прочностью и твердостью. Такая структура обеспечивает эффективную передачу механических нагрузок между атомами, что делает металлы с таким строением устойчивыми к деформации и износу.
Также стоит отметить, что ГЦК решетка обладает высокой термической устойчивостью. Благодаря своей плотной структуре, металлы с гранцентрированной кубической решеткой обычно имеют высокую температуру плавления и высокую теплопроводность, что делает их применимыми в высокотемпературных условиях.
Итак, гранцентрированная кубическая решетка является одной из ключевых структурных форм металлов. Ее высокая плотность упаковки, механическая прочность и термическая устойчивость делают ее популярным выбором для широкого спектра применений в различных отраслях промышленности.
Гранцентрированная гексагональная решетка
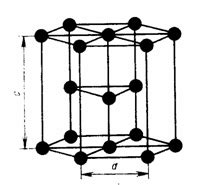
Гранцентрированная гексагональная решетка (ЦГ или hcp) является одним из вариантов атомно кристаллического строения металлов. В этой структуре каждый атом окружен шестью соседними атомами, расположенными в вершинах правильного шестиугольника, а также двумя атомами в центре каждой грани этого шестиугольника.
Гексагональное основание решетки образуется двумя подложками атомов, называемыми базальными плоскостями. Атомы, расположенные в плоскости, называются базальными атомами. Между базальными плоскостями находятся промежуточные плоскости, где расположены промежуточные атомы. Наиболее характерным представителем металлов с гранцентрированной гексагональной решеткой является цирконий.
Гранцентрированная гексагональная решетка обладает рядом особых свойств. Во-первых, эта решетка является компактной, то есть в ней отношение объема атомов к объему всего кристалла достигает значения 0,74. Во-вторых, благодаря своей компактности, гранцентрированная гексагональная решетка обладает высокой плотностью упаковки атомов, что делает металлы с такой решеткой твердыми и прочными. В-третьих, атомы в этой решетке располагаются вдоль базальных плоскостей, образуя слои, что объясняет некоторые особенности их магнитных и электрических свойств.
Основные характеристики

Атомно кристаллическое строение металлов - это один из главных факторов, определяющих их механические и физические свойства. Металлы обладают высокой плотностью, прочностью и хорошей проводимостью электричества и тепла.
В атомно кристаллической решетке металлов атомы располагаются в упорядоченном трехмерном пространственном порядке, образуя кристаллическую решетку. Это приводит к высокой упругости металлов, а также к их способности к деформации без разрушения.
Атомы металлов в кристаллической решетке обычно имеют структуру сферически симметричных электронных облаков с положительно заряженными ядрами в центре. Это позволяет электронам свободно перемещаться внутри металла и образовывать межатомные связи, что является причиной высокой проводимости электричества и тепла у металлов.
Одной из основных особенностей атомно кристаллического строения металлов является их способность к пластической деформации. Атомы металлов могут смещаться друг относительно друга без существенного нарушения кристаллической структуры, что позволяет металлам обладать высокой пластичностью. Благодаря этому свойству, металлы могут быть легко обработаны и получать различные формы, что делает их важным материалом для промышленности и строительства.
Металлическая связь

Металлическая связь является одной из основных характеристик металлов. Она возникает между положительными ионами металла и электронами, которые образуют "облако" свободных электронов, окружающих ионы. Эти свободные электроны являются общими для всех ионов и создают особое состояние металлической структуры, называемое электронным газом.
Металлическая связь отличается от других видов химических связей, таких как ионная или ковалентная связь. В металлической связи не происходит обмена электронами между атомами, она основана на общем использовании свободных электронов всех атомов металла. Это позволяет металлам обладать такими особенными свойствами, как высокая электропроводность, теплопроводность и пластичность.
Металлическое строение образуется благодаря металлической связи. В металлах атомы расположены в решетке, состоящей из положительных ионов металла и "облака" свободных электронов. Атомы металла занимают устойчивое положение в кристаллической решетке и могут совершать колебания вокруг своих положений. Это обеспечивает металлам их механические свойства.
Металлическая связь играет ключевую роль во многих свойствах металлов. Она объясняет, почему металлы обладают высокой электропроводностью, почему они обычно имеют блеск поверхности (из-за свободных электронов, которые способны отражать свет) и почему они могут быть легко деформированы при воздействии силы.
Вопрос-ответ

