Аллотропия - это явление изменения структуры и свойств вещества при сохранении его химического состава. В случае металлов это описание относится к различным кристаллическим модификациям, которые могут образовывать металлические элементы. Кристаллическая структура металлов определяет их механические, термические и электрические свойства, а аллотропия может значительно изменять эти характеристики.
Примером аллотропии металлов является железо. Оно может образовывать две различные кристаллические структуры: α-железо и γ-железо. При комнатной температуре железо находится в состоянии α-железа, которое имеет кубическую решетку и мягкое магнитное свойство. При нагревании до температуры около 910 градусов Цельсия происходит превращение α-железа в γ-железо, которое имеет более плотную гранехедральную структуру и становится немагнитным. При дальнейшем нагревании до 1400 градусов Цельсия происходит превращение γ-железа обратно в α-железо.
Еще одним примером аллотропии металлов является олово. Оно также может образовывать две различные кристаллические структуры: белое олово (α-олово) и серое олово (β-олово). Белое олово является стабильной формой при комнатной температуре и обладает металлическими свойствами. Серое олово образуется при нагревании белого олова до температуры около 13 градусов Цельсия и обладает хрупкостью и неметаллическими свойствами.
Понятие аллотропии металлов

Аллотропия – это свойство некоторых химических элементов изменять структуру и форму молекулы в зависимости от условий окружающей среды. Она проявляется и в отношении металлов. Аллотропные модификации металлов – это различные формы одного и того же металла, отличающиеся внутренней структурой и свойствами.
Примером аллотропии металлов является железо. В природе можно встретить две основные аллотропные формы железа: α-железо и γ-железо. Они отличаются кристаллической структурой, плотностью, температурой плавления и другими свойствами. α-железо более плотное и твердое, обладает ферромагнитными свойствами, а γ-железо менее плотное и твердое, ферромагнитность у него не выражена.
Интересный пример аллотропии – графит и алмаз, обе формы углерода. При аллотропной модификации алмаза атомы углерода соединяются в кристаллическую структуру, благодаря чему алмаз является крайне твердым. В графите же атомы углерода располагаются в слоях, что делает его мягким и хорошо проводящим электричество.
Вывод: аллотропные модификации металлов не только имеют различные свойства, но и используются в разных сферах человеческой деятельности. Знание об аллотропии позволяет создавать новые материалы с уникальными свойствами для быстрого развития различных индустрий и науки.
Что такое аллотропия металлов

Аллотропия металлов - это явление, при котором один и тот же химический элемент может существовать в различных структурных модификациях, называемых аллотропами.
Аллотропия металлов характеризуется изменением физических и химических свойств в зависимости от структурной формы. Аллотропические модификации металлов могут различаться по кристаллической структуре, атомной упаковке и электронной структуре.
Примером аллотропии металлов является железо, которое может существовать в нескольких аллотропических модификациях: α-железо, γ-железо и дельта-железо. Каждая модификация имеет свою кристаллическую структуру и свойства.
Аллотропные модификации металлов могут иметь различную устойчивость в зависимости от условий внешней среды, в которой они находятся. Так, при изменении температуры или давления аллотропные модификации металлов могут превращаться друг в друга.
Примеры аллотропии металлов
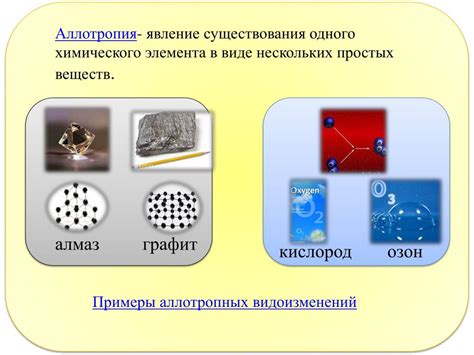
Углерод
Углерод – один из самых известных и широко распространенных аллотропных элементов. Он существует в различных структурных формах, называемых модификациями. Наиболее известными из них являются алмаз и графит. Алмаз – твердое, прозрачное вещество, имеющее неправильную геометрическую структуру. Графит же обладает слоистой структурой и является мягким и проводящим материалом. В последние годы были открыты и другие модификации углерода, такие как фуллерены и углеродные нанотрубки.
Железо
Железо также проявляет аллотропию и существует в двух основных формах – аустенитной (гранитной) и ферритной (ситечатой). Обе модификации железа отличаются своими механическими свойствами. Аустенитная форма железа является более крепкой и твердой, в то время как ферритная форма обладает большей пластичностью. Аллотропия железа играет большую роль в промышленности и определяет свойства стали и чугуна.
Фосфор
Примером аллотропии в металлургии является фосфор. Он существует в трех основных модификациях: белый, красный и черный фосфор. Белый фосфор - мягкий воск, обладающий ярко выраженным фотолюминесценцией. Красный фосфор выглядит как красно-фиолетовая кристаллическая субстанция и обладает физической стабильностью. Черный фосфор – термодинамически стабильная модификация, обладающая металлическими свойствами.
Свинец
Свинец проявляет аллотропность и существует в двух различных структурных формах – α- и β-свинца. Альфа-свинец - белое, гибкое и пластичное вещество. Бета-свинец - серое кристаллическое вещество, которое превращается в альфа-свинец при нагревании. Низкая температура перехода и механическая стабильность альфа-свинца делают его наиболее распространенной аллотропной формой свинца.
Аллотропные формы железа
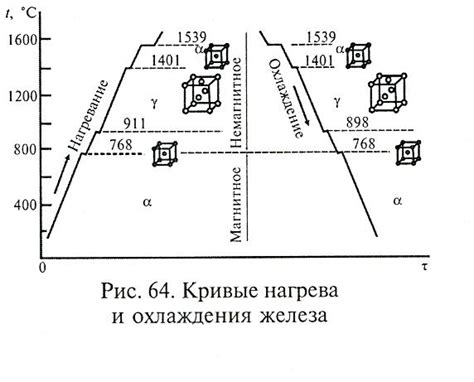
Железо является металлом, который имеет несколько аллотропных форм, то есть различных структурных модификаций, в которых все атомы железа расположены по-разному. Каждая аллотропная форма железа обладает уникальными свойствами и химической активностью.
Одной из наиболее распространенных аллотропных форм железа является α-железо. Оно обладает кубической решеткой, где каждый атом железа окружен шестью атомами другого железа. α-железо является стабильной при комнатной температуре и присутствует в основном в стальных сплавах.
Другой формой аллотропии железа является γ-железо. Оно также обладает кубической решеткой, но с более высокой энергией. γ-железо становится стабильным при повышении температуры до 912 градусов Цельсия.
Также существуют и другие формы аллотропии железа, например, β-железо, дельта-железо и эпсилон-железо. Каждая из этих форм имеет свои уникальные свойства и область применения.
Аллотропия железа играет важную роль в металлургии и инженерии. Она позволяет изготавливать сплавы с различными свойствами и применять их в разных областях, таких как строительство, авиация, электроника и многие другие.
Вопрос-ответ

Что такое аллотропия металлов?
Аллотропия металлов - это явление, при котором один и тот же металл может существовать в разных структурных формах, называемых аллотропными модификациями. Эти модификации отличаются своими физическими и химическими свойствами.
Какие металлы являются примерами аллотропии?
Примерами металлов, проявляющих аллотропию, являются железо и углерод. Железо может существовать в аллотропных формах, таких как феррит, аустенит и цементит. Углерод также обладает аллотропными модификациями, включая графит, алмаз, фуллерены и углеродные нанотрубки.
Каким образом аллотропия металлов влияет на их свойства?
Аллотропия металлов имеет огромное влияние на их свойства. Различные аллотропные формы металлов могут иметь разную прочность, эластичность, плотность и температуры плавления. Например, углерод в форме алмаза является крайне твердым и прозрачным, в то время как углерод в форме графита является мягким и хорошо проводящим электричество.
