Щелочные металлы являются химической группой элементов, которые включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они встречаются в природе в различных минералах и являются важными компонентами различных химических соединений.
Один из важных физических параметров щелочных металлов - радиус их атомов. Радиус атома - это половина расстояния между ядрами двух соседних атомов взаимодействующих между собой веществ. Размер атома щелочного металла может оказывать значительное влияние на его химические и физические свойства.
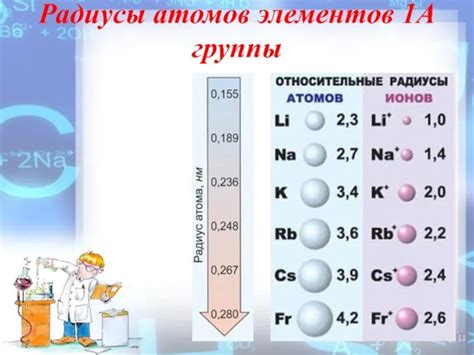
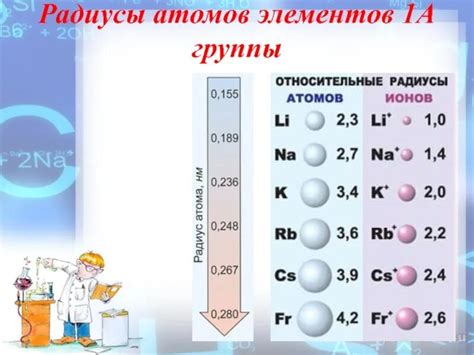
Все щелочные металлы имеют достаточно большие атомные радиусы, которые увеличиваются в порядке возрастания атомного номера. Например, атомный радиус лития составляет около 152 пикометров, в то время как у франция атомный радиус значительно больше - около 348 пикометров.
Общие сведения
Щелочные металлы – это элементы I группы периодической системы Менделеева, которые включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они получили свое название благодаря своей реактивности с водой, которая проявляется в образовании характерных щелочных растворов.
Радиусы атомов щелочных металлов являются одним из их основных свойств. Они обладают большими размерами, что связано с низкой электроотрицательностью и слабой атомной связью. Радиусы атомов щелочных металлов увеличиваются от лития к францию, что объясняется ростом количества электронных оболочек.
Литий, будучи первым элементом в группе, имеет наименьший радиус атома среди щелочных металлов. Затем следует наряду с нарастающим атомным номером увеличение радиуса натрия, калия, рубидия и цезия. Каждый следующий элемент в группе имеет больший радиус, чем предыдущий.
Размеры атомов щелочных металлов также возрастают по мере движения по горизонтали в периоде. Таким образом, литий имеет наименьший радиус атома среди щелочных металлов, а франций - наибольший.
Физические свойства щелочных металлов

Щелочные металлы – это группа элементов, включающая литий, натрий, калий, рубидий, цезий и франций. Они относятся к группе первых элементов (группа 1) периодической системы, и обладают рядом характерных физических свойств.
Первое из них – низкая плотность. Вещества, состоящие из щелочных металлов, обычно обладают очень низкой плотностью. Например, плотность калия составляет всего 0,86 г/см3, что делает его одним из самых легких металлов в природе.
Второе важное свойство – низкая температура плавления. Щелочные металлы обладают очень низкими точками плавления. Например, точка плавления натрия составляет всего 97,8 градусов Цельсия, а точка плавления лития – всего 180,5 градусов Цельсия. Это значит, что эти вещества могут легко переходить в жидкое состояние при небольшом нагревании.
Третье важное свойство – хорошая теплопроводность. Щелочные металлы обладают высокой теплопроводностью, то есть они хорошо проводят тепло. Это свойство делает их полезными материалами для использования в теплообменных системах и электропроводности.
Четвёртое свойство – химическая реактивность. Щелочные металлы весьма реактивны и быстро реагируют с водой, сильными кислотами и некоторыми галогенами. Это связано с их низкой энергией ионизации, что делает их хорошими донорами электронов. Их реактивность может быть использована в различных промышленных и химических процессах.
И наконец, пятое свойство – мягкость щелочных металлов. Щелочные металлы обладают низкой твердостью и мягкостью, что позволяет легко формировать их в различные формы. Некоторые щелочные металлы могут даже нарезаться ножом.
Влияние физических факторов на радиус атомов щелочных металлов
1. Заряд ядра и электронная оболочка: Физический фактор, оказывающий наибольшее влияние на радиус атомов щелочных металлов, это заряд ядра и количество электронов на последней электронной оболочке. Чем больше заряд ядра щелочного металла, тем сильнее электроотталкивающие силы между электронами и ядром, и тем меньше радиус атома.
2. Плотность электронов: Плотность электронов на оболочке также влияет на радиус атомов щелочных металлов. Большая плотность электронов приводит к более сжатой оболочке и меньшему радиусу атома.
3. Объем оболочки: Объем оболочки, занимаемый электронами, влияет на радиус атомов щелочных металлов. Большой объем оболочки приводит к увеличению радиуса атома.
4. Влияние окружающей среды: Окружающая среда также оказывает влияние на радиус атомов щелочных металлов. Ионы в окружающей плотной среде притягивают электроны и уменьшают радиус атома, в результате чего атом становится меньше.
5. Состояние атома: Радиус атомов щелочных металлов может меняться в зависимости от его состояния. Возбуждение атомов, их ионизация или связывание с другими атомами может приводить к изменению радиуса.
Сравнительный анализ радиусов атомов щелочных металлов
Щелочные металлы – это элементы первой группы в периодической системе, включающие литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Одной из важных характеристик атомов щелочных металлов является их радиус.
Радиус атома – это расстояние от центра ядра до наружного электрона в атоме. В случае щелочных металлов, радиус атома увеличивается по мере движения по группе вниз. Это связано с увеличением числа электронных оболочек и слоев электронов.
Так, у лития, наименьшего элемента первой группы, радиус атома составляет около 152 пикометра (1 пикометр = 10^(-12) метра), тогда как у франция, самого тяжелого элемента группы, радиус атома значительно больше и составляет около 348 пикометров. Расширение радиуса связано с постепенным добавлением новых электронных оболочек и увеличением ядра атома.
Более точные значения радиусов атомов щелочных металлов можно найти в таблице ниже:
| Элемент | Радиус атома (пикометры) |
|---|---|
| Литий (Li) | 152 |
| Натрий (Na) | 186 |
| Калий (K) | 227 |
| Рубидий (Rb) | 248 |
| Цезий (Cs) | 265 |
| Франций (Fr) | 348 |
Следует отметить, что радиус атома может быть менее точной характеристикой, чем, например, ионный радиус. Однако, сравнительный анализ радиусов атомов щелочных металлов позволяет увидеть общую тенденцию увеличения радиуса по группе и обнаружить общие особенности в строении атомов щелочных металлов.
Вопрос-ответ

Что такое щелочные металлы?
Щелочные металлы - это группа элементов периодической таблицы, которая включает литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs), и франций (Fr). Они являются очень реактивными металлами, легко образующими катионы с положительным зарядом и обладающими химической активностью.
Каковы общие особенности радиусов атомов щелочных металлов?
Общая тенденция радиусов атомов щелочных металлов состоит в увеличении радиуса от лития к францию. Это связано с увеличением количества электронных оболочек и снижением силы притяжения ядра к электронам на более дальних оболочках. Также влияет эффективное экранирование электронов внешней оболочки более внутренними электронами.
Влияет ли заряд ядра на радиус атомов щелочных металлов?
Да, заряд ядра оказывает влияние на радиус атомов щелочных металлов. Радиус атома уменьшается при увеличении заряда ядра. Например, радиус атома лития меньше, чем радиус атома натрия, потому что заряд ядра натрия больше, и оно притягивает внешние электроны сильнее.
Какие факторы влияют на радиус атомов щелочных металлов?
На радиус атомов щелочных металлов влияют несколько факторов. Основными из них являются количество электронных оболочек и заряд ядра. Увеличение количества электронных оболочек приводит к увеличению радиуса, а увеличение заряда ядра - к его уменьшению. Также влияет эффективное экранирование электронов внешней оболочки электронами внутренних оболочек.
