Реакция оксидов щелочных металлов с водой - это одна из фундаментальных химических реакций. Она имеет большое значение как в химической технологии, так и в естественных науках, поскольку приводит к образованию гидроксидов щелочных металлов. Щелочные металлы, такие как литий (Li), натрий (Na), калий (K), рубидий (Rb) и цезий (Cs), образуют стабильные гидроксиды, которые широко используются в различных отраслях промышленности и научных исследованиях.
Процесс образования гидроксидов начинается с реакции оксидов щелочных металлов с водой. В результате этой реакции оксиды переходят в гидроксиды, а вода играет роль активного агента. Реакция происходит при обычных условиях температуры и давления, что делает ее легко контролируемой и применимой в различных областях.
Формирующиеся гидроксиды щелочных металлов обладают высокой растворимостью в воде, что обеспечивает быструю и эффективную реакцию. Они имеют сильную щелочную реакцию и способны образовывать гидроксиды с различными степенями гидратации. Гидроксиды щелочных металлов широко используются в производстве щелочей, стекла, мыла, а также в других отраслях химической промышленности и научных исследований.
Образование гидроксидов при взаимодействии оксидов щелочных металлов с водой

Реакция между оксидами щелочных металлов и водой приводит к образованию гидроксидов - основных соединений, которые состоят из ионов металла и гидроксильного иона (OH-). Эта реакция является классическим примером реакции нейтрализации, где кислотный оксид соединяется с водой, образуя нейтральное соединение - гидроксид.
Основным представителем щелочных металлов является натрий, а его оксид - оксид натрия (Na2O). При контакте с водой оксид натрия реагирует, образуя гидроксид натрия (NaOH) и выделяя большое количество тепла. Эта реакция является экзотермической и протекает очень быстро.
Подобным образом взаимодействуют и другие оксиды щелочных металлов. Например, оксид калия (K2O) с водой дает гидроксид калия (KOH) и также сопровождается выделением тепла. Эти реакции являются очень быстрыми и сильно взрывоопасными, поэтому требуют особого внимания и осторожности в обращении с такими веществами.
Образование гидроксидов при взаимодействии оксидов щелочных металлов с водой является важным процессом в химии и имеет множество применений. Гидроксиды, такие как гидроксид натрия и гидроксид калия, используются в различных отраслях промышленности, в медицине, а также являются основой для производства щелочей и много других соединений.
Механизм образования гидроксидов
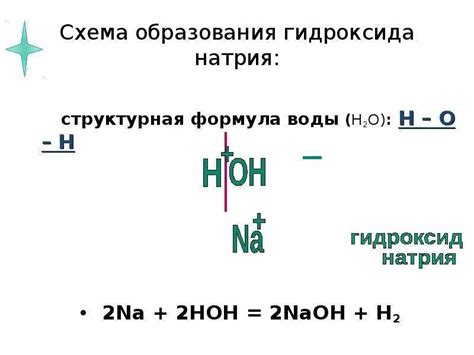
Образование гидроксидов при реакции оксидов щелочных металлов с водой осуществляется через ряд химических реакций.
Процесс начинается с диссоциации молекулы воды на ионы водорода (H+) и гидроксид-иона (OH-). В случае щелочных металлов, окислы образуются через присоединение молекулы кислорода к иону металла.
Когда оксид взаимодействует с водой, ионы водорода проявляют кислотные свойства, реагируя с гидроксид-ионами. Ионы металла, в свою очередь, проявляют щелочные свойства, образуя гидроксид. При этом оксид превращается в гидроксид и реакция сопровождается выделением тепла.
Механизм образования гидроксидов может быть представлен следующей схемой:
- Молекула воды (H2O) диссоциирует на ионы водорода (H+) и гидроксид-иона (OH-).
- Молекула оксида (MO) взаимодействует с ионами водорода, образуя молекулу воды и обладающий щелочными свойствами гидроксид металла (M(OH)).
- Реакция сопровождается выделением тепла.
Таким образом, образование гидроксидов при реакции оксидов щелочных металлов с водой осуществляется путем взаимодействия молекулы воды с оксидом, в результате чего образуется гидроксид металла, проявляющий щелочные свойства.
Свойства гидроксидов щелочных металлов

Гидроксиды щелочных металлов являются основаниями, образующимися при реакции оксидов этих металлов с водой. Они обладают рядом характерных свойств, которые делают их важными веществами в различных областях промышленности и химии.
Во-первых, гидроксиды щелочных металлов обладают щелочными свойствами и способны разлагать кислоты, образуя соль и воду. Это делает их полезными в процессах нейтрализации кислотных растворов.
Во-вторых, гидроксиды щелочных металлов обладают высокой щелочностью, что позволяет им использоваться в процессах очистки воды. Они способны нейтрализовывать кислотные примеси в воде и образовывать нерастворимые осадки, которые можно отфильтровать.
В-третьих, гидроксиды щелочных металлов обладают амфотерными свойствами, то есть они могут образовывать как соли с кислотами, так и с ионами гидроксида. Это делает их полезными в качестве составляющих различных химических соединений и материалов.
Наконец, гидроксиды щелочных металлов обладают высокой растворимостью в воде, что обеспечивает им хорошую способность взаимодействовать с различными веществами и быть использованными в различных химических реакциях.
В целом, свойства гидроксидов щелочных металлов делают их важными соединениями, широко применяемыми в различных отраслях промышленности и химии.
Практическое применение гидроксидов щелочных металлов

Гидроксиды щелочных металлов, такие как гидроксид натрия (NaOH) и гидроксид калия (KOH), широко используются в различных отраслях промышленности и научных исследованиях.
В производстве мыла гидроксид натрия, также известный как каустическая сода, часто используется как основной компонент. Он реагирует с жирными кислотами, образуя мыло и глицерин. Этот процесс называется сапонификацией и является одним из основных способов производства мыла.
В стекольной промышленности гидроксид калия используется в процессе производства стекла. Он используется для очистки сырья и регулирования pH растворов во время процесса стеклотворения. Гидроксид калия также добавляется в определенные типы стекла, чтобы придать ему особые свойства, например, устойчивость к высоким температурам.
В производстве удобрений гидроксид натрия и гидроксид калия используются для производства аммиачной селитры и других типов удобрений. Они реагируют с аммиаком, образуя нитраты, которые являются основными компонентами удобрений для растений.
В проведении лабораторных исследований гидроксиды щелочных металлов широко применяются для регулирования pH растворов, осаждения металлов, выполнения химических реакций и титрования. Они также используются в качестве электролитов для электрохимических исследований.
В качестве щелочных растворов гидроксиды щелочных металлов используются для нейтрализации кислотных растворов, очистки и дезинфекции поверхностей и передачи тепла в некоторых системах охлаждения.
В производстве щелочей и солей гидроксиды щелочных металлов используются как основной компонент для производства других щелочей, солей, химических реагентов и продуктов бытового назначения. Например, гидроксид натрия используется для производства пищевых добавок, моющих средств, бумаги и текстиля.
В разработке энергетических технологий гидроксиды щелочных металлов используются в процессе электролиза, который является основным способом производства водорода и других водородсодержащих веществ. Эти вещества широко применяются в топливных элементах, аккумуляторах и других энергетических технологиях.
Практическое применение гидроксидов щелочных металлов распространено в многих областях промышленности, технологии и исследованиях. Их уникальные свойства и реакционная способность делают их незаменимыми компонентами во многих процессах и продуктах, сыгравшими значительную роль в современном обществе.
Вопрос-ответ

Какие гидроксиды образуются при реакции оксидов щелочных металлов с водой?
Оксиды щелочных металлов, такие как оксид натрия (Na₂O), оксид калия (K₂O) и оксид лития (Li₂O) реагируют с водой, образуя соответствующие гидроксиды. В результате реакции, образуются гидроксид натрия (NaOH), гидроксид калия (KOH) и гидроксид лития (LiOH).
Какие свойства имеют гидроксиды, образующиеся при реакции оксидов щелочных металлов с водой?
Гидроксиды, образующиеся при реакции оксидов щелочных металлов с водой, являются щелочами. Они обладают щелочным вкусом, образуют густые растворы и обладают щелочной реакцией. Гидроксиды щелочных металлов также хорошо растворимы в воде, и их растворы обладают щелочными свойствами, такими как способность нейтрализовать кислоты и образовывать соли.
Каков механизм реакции образования гидроксидов при взаимодействии оксидов щелочных металлов с водой?
Механизм реакции образования гидроксидов при взаимодействии оксидов щелочных металлов с водой основан на процессе гидратации оксида. Водяные молекулы реагируют с оксидами щелочных металлов, приводя к разложению оксида и образованию соответствующего гидроксида. Для этого требуется энергия, которая выделяется в форме тепла.
