Элементы главной подгруппы периодической системы, находящиеся в группе 1A-8A, называются металлами главной подгруппы. Обладая химическими свойствами, присущими металлам, эти элементы играют важную роль во многих технологических процессах и имеют широкое применение в различных отраслях промышленности. Одним из способов изменения их химических свойств является варьирование числа электронов на внешнем энергетическом уровне атома.
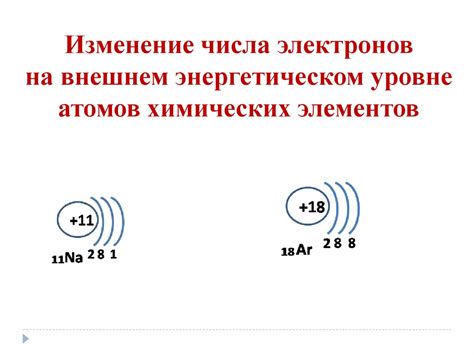
Металлы главной подгруппы имеют внешний уровень s или p энергии. Изменение числа электронов на внешнем уровне атома обусловлено присоединением или отщеплением электронов от металлического атома. Это приводит к образованию ионов, имеющих положительный или отрицательный заряд. В результате такого варьирования числа электронов, изменяются химические свойства этих металлов, что, в свою очередь, полезно при создании новых материалов или при изменении их физических и химических свойств.
Анализ возможностей варьирования числа электронов на внешнем уровне атома металла главной подгруппы позволяет предсказать и изучить новые вещества, обладающие улучшенными или специальными свойствами. Это открывает широкие перспективы для разработки новых материалов с повышенными механическими, электрическими, магнитными и другими полезными свойствами, которые могут быть применены в различных областях промышленности и науки.
Анализ возможностей варьирования числа электронов на внешнем уровне атома металла главной подгруппы периодической системы
Периодическая система химических элементов представляет собой удобный инструмент для описания и систематизации различных химических свойств элементов. Изучение возможностей варьирования числа электронов на внешнем уровне атома металла главной подгруппы периодической системы является важной задачей с точки зрения понимания и прогнозирования химических свойств веществ.
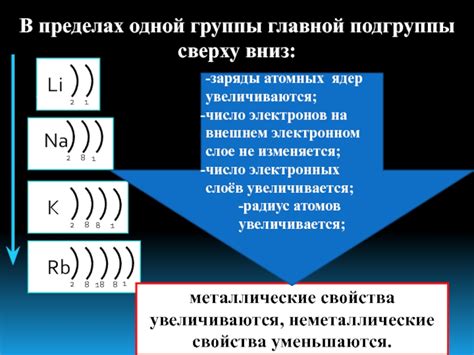
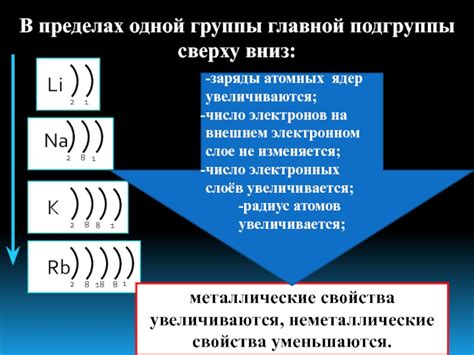
В главной подгруппе периодической системы находятся металлы, которые обладают особыми свойствами и широко используются в различных отраслях промышленности. Эти металлы имеют наиболее стабильное число электронов на внешнем энергетическом уровне и формируют ионы с постоянным зарядом.
Варьирование числа электронов на внешнем уровне атома металла главной подгруппы возможно за счет образования соединений с другими элементами. Металлы главной подгруппы могут образовывать соединения с элементами побочных подгрупп, такими как галогены и кислород. В результате реакции образуются ионы металла с разным зарядом, что позволяет менять число электронов на внешнем уровне атома.
Например, атом меди (Cu) имеет на внешнем уровне два электрона. В реакции с кислородом (O), медь может образовать соединение CuO, в котором у меди теперь один электрон на внешнем уровне. Атом меди может также образовывать соединения с галогенами, например CuCl2, где у меди имеется два электрона на внешнем уровне. Варьирование числа электронов на внешнем уровне металла позволяет изменять его химические свойства и использовать для различных целей.
Другим примером металла, имеющего возможность варьирования числа электронов на внешнем уровне, является железо (Fe). Железо может образовывать соединения с кислородом, образуя различные оксиды (FeO, Fe2O3 и др.), в которых число электронов на внешнем уровне может меняться. Это позволяет использовать железо для создания различных типов сталей с разными свойствами.
Варьирование числа электронов на внешнем уровне атома металла главной подгруппы периодической системы предоставляет широкие возможности для создания различных материалов с уникальными свойствами. Изучение этих возможностей позволяет разрабатывать новые материалы с заданными химическими и физическими свойствами, что является важным для различных сфер промышленности и науки.
Роль внешнего уровня атома металла главной подгруппы

Внешний уровень атома металла главной подгруппы играет важную роль в его химических свойствах. Этот уровень образует внешнюю оболочку атома, на котором находятся валентные электроны. Такие электроны могут участвовать в химических реакциях и обеспечивать металлу его основные свойства.
Число электронов на внешнем уровне атома металла главной подгруппы определяет его химическую активность. Чем больше электронов на внешнем уровне, тем больше возможностей для образования химических связей и реакций с другими атомами. Это делает металл более реакционноспособным и химически активным.
Внешний уровень атома металла главной подгруппы также определяет его способность образовывать ионные соединения. При потере или приобретении электрона атом металла может образовать положительный или отрицательный ион, что позволяет ему образовывать стабильные и химически инертные соединения с другими элементами.
Важно отметить, что внешний уровень атома металла главной подгруппы также может влиять на его электропроводность и теплопроводность. Присутствие свободных электронов на внешнем уровне позволяет металлу эффективно передавать электрический ток и тепло.
Влияние числа электронов на свойства металлов
Число электронов на внешнем уровне атома металла влияет на его свойства и характеристики. Оно определяет химическую активность металла и его способность образовывать химические связи с другими элементами.
Металлы с большим числом электронов на внешнем уровне обычно проявляют высокую активность. В связи с этим, такие металлы легко реагируют с другими веществами и могут образовывать различные соединения. Например, щелочные металлы, такие как натрий и калий, имеют только один электрон на внешнем уровне и активно реагируют с водой и кислородом.
С другой стороны, металлы с малым числом электронов на внешнем уровне могут быть менее активными и менее склонными к химическим реакциям. Например, медь имеет два электрона на внешнем уровне и является менее активной, чем щелочные металлы. Также медь обладает высокой электропроводностью и является хорошим проводником электричества.
Таким образом, число электронов на внешнем уровне атома металла играет важную роль в определении его химических и физических свойств. Эта характеристика позволяет классифицировать металлы по их активности и способности образовывать химические соединения, а также объясняет некоторые их свойства, такие как электропроводность или твердость.
Анализ возможностей изменения числа электронов на внешнем уровне
Число электронов на внешнем уровне атома металла главной подгруппы периодической системы может изменяться в зависимости от реактивности и химических свойств элемента. Данная характеристика играет важную роль в формировании соединений и определяет их реакционную активность.
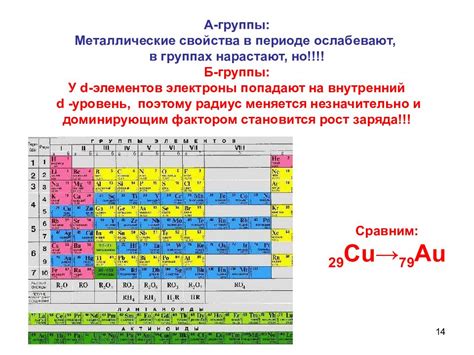
Металлы главной подгруппы периодической системы имеют общую черту - электронная конфигурация валентной оболочки, состоящей из s- и p-орбиталей. Варьирование числа электронов на этой оболочке возможно благодаря наличию свободных электронов, которые могут участвовать в образовании химических связей.
Наиболее известными представителями металлов главной подгруппы являются элементы 13-16 групп периодической системы: бор, алюминий, галлий, индий и таллий. Валентное число этих элементов может варьироваться от +1 до +3. Например, бор образует стабильные соединения в валентном состоянии +3, алюминий - в состоянии +3 и иногда +1. Различия в валентных состояниях возникают из-за изменения зарядов атомов при образовании химических связей.
Возможность варьирования числа электронов на внешнем уровне позволяет металлам главной подгруппы образовывать различные химические соединения с другими элементами. Это свойство широко используется в различных отраслях науки и техники, например, в производстве сплавов и катализаторов.
Варьирование числа электронов и его влияние на специфические свойства металлов

Число электронов на внешнем уровне атома металла является ключевым фактором, определяющим его свойства. Варьирование этого числа может привести к изменению многих характеристик металлов, включая их химическую реактивность, электропроводность и магнитные свойства.
Когда число электронов на внешнем уровне металла увеличивается, это может привести к повышению его химической активности. Электроны на внешнем уровне имеют больше свободного пространства для взаимодействия с другими атомами, что может способствовать возникновению химических реакций. Это может быть полезно для металлов, используемых в качестве катализаторов или в процессах синтеза химических соединений.
Кроме того, число электронов на внешнем уровне может влиять на электропроводность металлов. Электроны, находящиеся на внешнем уровне, могут свободно перемещаться по кристаллической решетке металла, создавая электрический ток. Большее число электронов на внешнем уровне может увеличить электропроводность металла. Это свойство делает металлы ценными для использования в проводниках электрического тока.
Кроме того, число электронов на внешнем уровне может влиять на магнитные свойства металлов. Некоторые металлы, такие как железо и никель, обладают магнитными свойствами благодаря особому расположению электронов на их внешнем уровне. Изменение числа этих электронов может изменить магнитные свойства металла, включая его способность к ферромагнетизму или антиферромагнетизму.
Варьирование числа электронов на внешнем уровне атома металла главной подгруппы периодической системы предоставляет возможности для создания металлических соединений с различными свойствами. Понимание этого влияния может быть полезным при разработке новых материалов с определенными характеристиками, таких как проводимость, магнитные свойства и реакционная активность.
Возможности контроля числа электронов на внешнем уровне и их практическое применение
Возможность контролировать число электронов на внешнем уровне атома металла главной подгруппы периодической системы открывает широкие перспективы для практического применения в различных областях науки и технологий. Эта контрольная возможность основана на способности металлов главной подгруппы образовывать химические соединения и вступать во взаимодействие с другими элементами.
Одним из практических применений контроля числа электронов на внешнем уровне является синтез и разработка новых материалов с уникальными свойствами. Модификация внешнего электронного уровня позволяет изменять электронное строение материалов, что приводит к изменению таких характеристик, как электропроводность, магнитные свойства, оптическое поведение и многое другое. Это открывает возможности для создания новых материалов с широким спектром применений в различных отраслях промышленности и науки.
Контроль числа электронов на внешнем уровне также может быть использован для создания катализаторов с улучшенной активностью и выборочностью. Подбор металлического катализатора с определенным числом электронов на внешнем уровне позволяет управлять химическими реакциями, увеличивая скорость и эффективность процессов.
Другой важной областью применения контроля числа электронов на внешнем уровне является электрохимия. Путем изменения электронной конфигурации можно создавать новые электроды с улучшенными свойствами, такими как стабильность, электроактивность и электрокаталитическая активность. Это открывает новые возможности для развития энергетических устройств, аккумуляторов и сенсоров, а также для разработки новых способов электросинтеза органических соединений.
Вопрос-ответ

Зачем варьировать число электронов на внешнем уровне атома металла главной подгруппы периодической системы?
Варьирование числа электронов на внешнем уровне атома металла главной подгруппы периодической системы позволяет изменять его химические свойства и использовать его в различных реакциях и соединениях. Это может быть полезно, например, при создании новых материалов с определенными свойствами или в катализе, где изменение числа электронов может повлиять на реакционную активность металла.
Как можно варьировать число электронов на внешнем уровне атома металла главной подгруппы периодической системы?
Число электронов на внешнем уровне атома металла главной подгруппы периодической системы можно варьировать, изменяя его окислительное состояние или создавая специальные соединения с другими элементами. Для этого можно изменять условия реакций, добавлять различные вещества или контролировать температуру и давление.
Какое значение имеет варьирование числа электронов на внешнем уровне атома металла главной подгруппы периодической системы?
Варьирование числа электронов на внешнем уровне атома металла главной подгруппы периодической системы имеет большое значение в различных областях науки и техники. Например, это позволяет создавать новые материалы с определенными электронными и физическими свойствами, такие как проводимость электричества или магнитные свойства. Также это имеет значение в разработке катализаторов, которые используются в различных процессах в промышленности и химии.
