Один из основных химических свойств металлов заключается в том, что у них наличие свободных электронов на внешнем энергетическом уровне. Их ионизация позволяет металлам образовывать положительные ионы и электроннейтральные связи с другими элементами. В то время как не металлы, включая такие элементы, как кислород, азот и хлор, имеют тенденцию образовывать отрицательные ионы.
В основном, у атомов металлов электростатические силы притяжения между ядром и внешним электроном меньше, чем у атомов не металлов. Это объясняет наличие свободных электронов на внешнем энергетическом уровне. Обычно металлы имеют от одного до трех электронов на своем внешнем энергетическом уровне.
Этот факт делает металлы хорошими проводниками электричества и тепла. Следует отметить, что не все атомы металлов имеют одинаковое число электронов на внешнем энергетическом уровне, поскольку это зависит от их атомной структуры. Но в целом, большинство атомов металлов имеют один или два электрона на своем внешнем энергетическом уровне.
Сколько электронов на внешнем энергетическом уровне металлов?
Электронная структура атомов металлов описывает распределение электронов по энергетическим уровням. Атом металла состоит из ядра и облака электронов, которые находятся на различных энергетических уровнях вокруг ядра.
Внешний энергетический уровень атома металла определяет его химические свойства и способность образовывать химические связи с другими атомами. Этот уровень называется валентным уровнем и содержит валентные электроны.
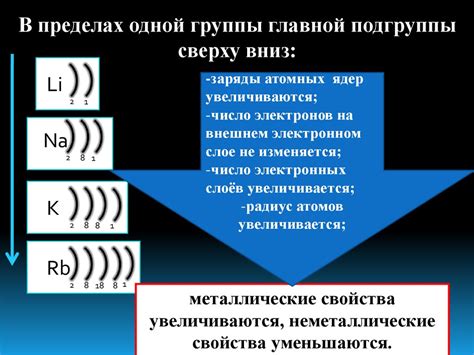
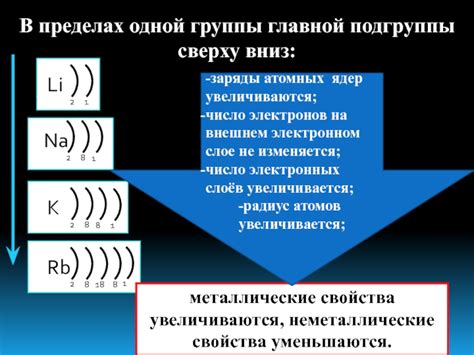
Число валентных электронов на внешнем энергетическом уровне металлов может варьироваться от одного до нескольких, в зависимости от их положения в периодической таблице элементов. Например, атомы металлов в периоде 1 (например, литий и натрий) имеют один валентный электрон на своем внешнем энергетическом уровне.
Атомы металлов в периодах 2 и 3 (например, магний и алюминий) имеют два валентных электрона на своем внешнем энергетическом уровне. Другие металлы, такие как железо и медь, имеют различное число валентных электронов в зависимости от своего положения в периодической таблице.
Таким образом, количество электронов на внешнем энергетическом уровне металлов может быть разным, и оно играет важную роль в химической активности и взаимодействии атомов металлов с другими элементами.
Определение электронной конфигурации
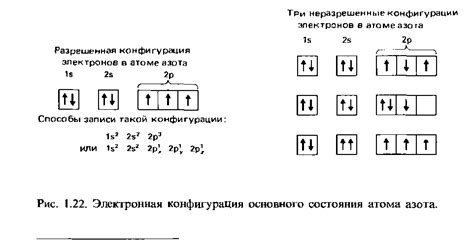
Электронная конфигурация – это распределение электронов по энергетическим уровням и подуровням в атоме. Она определяет, сколько электронов находится на каждом энергетическом уровне и на каких подуровнях. Электронная конфигурация позволяет предсказать химические свойства атомов и объяснить их расположение в периодической таблице.
Для определения электронной конфигурации металлов необходимо знать число электронов на их внешнем энергетическом уровне. В большинстве случаев оно равно количеству электронов на s- или p-подуровне последней оболочки атома металла. На внешнем уровне атома металла может находиться от 1 до 8 электронов. Это определяет химические свойства металлов и их способность образовывать соединения с другими элементами.
Например, у железа (Fe) электронная конфигурация в основном состоянии будет выглядеть следующим образом: 1s2 2s2 2p6 3s2 3p6 4s2 3d6. Здесь 4s2 - внешний энергетический уровень с 2 электронами, которые определяют химические свойства железа.
Знание электронной конфигурации металлов позволяет предсказать их активность, способность к окислению и восстановлению, а также их химическое поведение в реакциях. Этот факт является важной основой для изучения и понимания свойств металлов и их применения в различных областях, включая промышленность и технологии.
Энергетические уровни атомов металлов
Энергетические уровни атомов металлов определяют распределение электронов вокруг ядра и влияют на их химические свойства. Основные энергетические уровни атомов металлов образуются благодаря энергетическим уровням, которые представлены электронными оболочками.
Наиболее внешний энергетический уровень атомов металлов называется внешним энергетическим уровнем. Он определяет химическую активность и способность металлов образовывать соединения с другими элементами.
Внешний энергетический уровень атома металла может содержать от одного до восьми электронов. Количество электронов на внешнем уровне определяет классификацию металлов в таблице Менделеева.
- Если на внешнем энергетическом уровне находится один или два электрона, то такие металлы относятся к первой или второй группе.
- Если на внешнем энергетическом уровне находится три электрона, то такие металлы относятся к третьей группе.
- Если на внешнем энергетическом уровне находится четыре или пять электронов, то такие металлы относятся к четвертой или пятой группе.
- Если на внешнем энергетическом уровне находится шесть или семь электронов, то такие металлы относятся к шестой или седьмой группе.
- Если на внешнем энергетическом уровне находится восемь электронов, то такие металлы относятся к восьмой группе и называются инертными газам.
Количество электронов на внешнем энергетическом уровне атомов металлов имеет важное значение при формировании химических соединений и определяет их химические свойства, реакционную способность и способы взаимодействия с другими элементами.
Закономерность: число электронов на внешнем уровне
Электронные оболочки атомов
Атомы металлов состоят из электронов, которые располагаются на энергетических уровнях, также называемых электронными оболочками. Каждая электронная оболочка может содержать определенное число электронов. Наиболее удаленная от ядра оболочка называется внешней, именно электроны этой оболочки принимают участие в химических реакциях и обладают наибольшим энергетическим потенциалом.
Число электронов на внешнем уровне
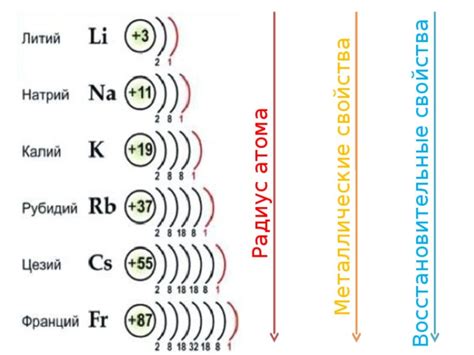
Закономерность, определяющая число электронов на внешнем уровне атомов металлов, можно объяснить на примере периодической системы химических элементов. В основном, металлы относятся к д-элементам и находятся в левой части периодической системы, в группах 1-12. Часто у них внешний энергетический уровень содержит один или два электрона. Например, у атома калия внешняя оболочка содержит один электрон, у железа - два электрона.
Связь между числом электронов и свойствами металлов
Число электронов на внешнем уровне связано с химическими и физическими свойствами металлов. Эти свойства определяются способностью атома металла отдавать или принимать электроны. Металлы с одним электроном на внешнем уровне, как например, литий и натрий, обладают высокой химической реактивностью и способностью образовывать ионные соединения с другими элементами. В то время как металлы с двумя электронами на внешнем уровне, такие как магний и кальций, менее реактивны и склонны образовывать ионные соединения с различными антионами.
Заключение
Количество электронов на внешнем энергетическом уровне атомов металлов не является случайным, а определяется их положением в периодической системе элементов. Определенное число электронов на внешнем уровне влияет на химические и физические свойства металлов, делая их реактивными или менее реактивными в химических реакциях.
Вопрос-ответ

Почему число электронов на внешнем энергетическом уровне большинства атомов металлов равно?
Число электронов на внешнем энергетическом уровне большинства атомов металлов равно, так как они находятся в s- или p-подуровне валентной оболочки. Это связано с особенностями строения электронных оболочек атомов, где валентная оболочка содержит наиболее энергетически выгодное количество электронов. В металлах эти электроны легко участвуют в химических реакциях, образуя ионы и связи с другими атомами или молекулами.
Какие именно металлы имеют на внешнем энергетическом уровне равное число электронов?
На внешнем энергетическом уровне равное число электронов имеют металлы, у которых валентная оболочка содержит s- или p-подуровни. К таким металлам относятся, например, кальций, магний и алюминий. Они имеют соответственно 2, 2 и 3 электрона на своем внешнем энергетическом уровне.
Какую роль играют эти электроны в химических свойствах металлов?
Электроны на внешнем энергетическом уровне металлов играют важную роль в их химических свойствах. Эти электроны легко участвуют в химических реакциях, образуя ионы или связи с другими атомами или молекулами. Они определяют способность металлов образовывать различные соединения и связываться с другими веществами. Именно благодаря этим электронам металлы обладают множеством полезных свойств, таких как электропроводность, теплопроводность и пластичность.
Что произойдет, если металл потеряет электрон на внешнем энергетическом уровне?
Если металл потеряет электрон на внешнем энергетическом уровне, он станет положительно заряженным ионом. Это происходит при образовании ионов металлов. Например, натрий, имеющий один электрон на внешнем энергетическом уровне, при вступлении в химическую реакцию может потерять этот электрон и превратиться в ион с положительным зарядом Na+. Это обуславливает большую реакционную способность металлов и их способность образовывать ионы в процессе химических превращений.
