Щелочноземельные металлы – это химическая группа элементов периодической системы, которые находятся во 2 группе. Эти элементы обладают малой электроотрицательностью, что делает их металлическими. Одной из важных характеристик атомов щелочноземельных металлов является количество электронов на внешнем энергетическом уровне.
Научное сообщество установило, что количество электронов на внешнем энергетическом уровне атомов щелочноземельных металлов всегда равно 2. Это следует из строения электронной оболочки. Внешняя оболочка атома щелочноземельного металла содержит 2 электрона, что делает эти элементы особенными и уникальными в своем роде.
Данный факт имеет важное значение в химических реакциях и свойствах щелочноземельных металлов. Каждый атом этих элементов стремится отдать свои 2 электрона в химической реакции, чтобы достичь стабильности. Именно поэтому щелочноземельные металлы имеют склонность к образованию ионов с положительным зарядом.
Знание о количестве электронов на внешнем энергетическом уровне атомов щелочноземельных металлов позволяет понять их химические свойства и использовать эти элементы в различных сферах науки и промышленности. Это также помогает предсказывать и объяснять химические реакции и взаимодействия, в которых участвуют щелочноземельные металлы.
Свойства атомов щелочноземельных металлов

Атомы щелочноземельных металлов отличаются особыми свойствами на внешней энергетической оболочке, где находятся электроны. Внешняя оболочка каждого атома щелочноземельного металла содержит два электрона, что делает их атомы очень реактивными и склонными к образованию ионов.
Ионы щелочноземельных металлов имеют положительный заряд, так как они могут легко отдать свои два валентных электрона. Это свойство делает их хорошими кандидатами для образования ионных соединений с другими элементами, особенно с элементами, которые имеют отрицательный заряд.
Атомы щелочноземельных металлов также характеризуются высокими температурами плавления и кипения. Это свойство объясняется тем, что их валентные электроны очень слабо связаны с ядром атома, что ведет к слабому взаимодействию между атомами щелочноземельных металлов и, следовательно, позволяет им быстро переходить в газообразное состояние.
Еще одним свойством атомов щелочноземельных металлов является их способность к образованию сплавов. Взаимодействие ионов щелочноземельных металлов с ионами других элементов позволяет создавать различные сплавы с различными свойствами, что делает их полезными в разных областях промышленности.
В целом, атомы щелочноземельных металлов обладают уникальными характеристиками на внешней энергетической оболочке, что позволяет им проявлять разнообразные свойства и применяться в различных областях научных и промышленных исследований.
Энергетические уровни атомов
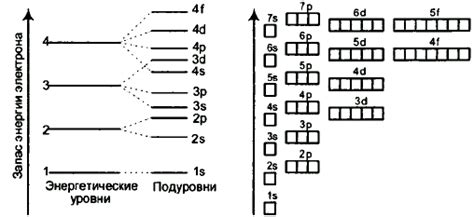
Энергетические уровни атомов являются основными состояниями частиц, на которых они могут находиться. Уровни энергии являются квантовыми состояниями, которые определяют возможные значения энергии частицы. В атоме энергетические уровни определяют распределение электронов по орбиталям.
Для атомов щелочноземельных металлов, таких как магний, кальций и др., число электронов на внешнем энергетическом уровне равно двум. Это означает, что на последней энергетической оболочке атома этих элементов находятся два электрона.
Число электронов на внешнем энергетическом уровне определяет химические свойства атомов щелочноземельных металлов. Наличие двух электронов на последней оболочке делает эти атомы химически активными, так как они стремятся завязаться с другими атомами и образовать химические связи.
Электроны на внешнем энергетическом уровне могут участвовать в химических реакциях и образовывать связи с другими атомами. Это объясняет химическую активность щелочноземельных металлов и их способность образовывать ионы с положительным зарядом.
Знание числа электронов на внешнем энергетическом уровне атомов щелочноземельных металлов позволяет предсказывать их химическое поведение и взаимодействие с другими веществами. Эта информация играет важную роль в химии и технологии и помогает понять основы химических реакций и свойств веществ.
Щелочноземельные металлы и их электроны
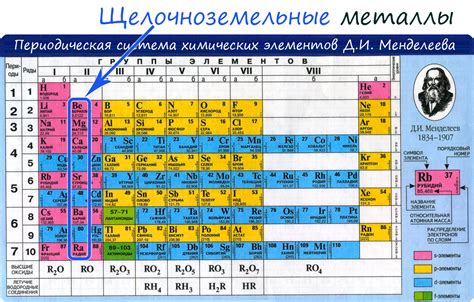
Щелочноземельные металлы - это группа элементов периодической таблицы, включающая бериллий, магний, кальций, стронций, барий и радий. У этих металлов характерной особенностью является наличие двух электронов на внешнем энергетическом уровне.
Перед тем как рассмотреть число электронов на внешнем энергетическом уровне ущелочноземельных металлов, важно вспомнить о строении атома. Атом состоит из центрального ядра, в котором находятся протоны и нейтроны, и облака электронов, движущихся по различным энергетическим уровням.
У щелочноземельных металлов внешний энергетический уровень заполняется электронами в следующем порядке: s-подобная оболочка. Заполение электронов начинается с электрона на первом энергетическом уровне - s-подобной оболочке, и продолжается до заполнения 8 электронов в s-подобной оболочке на втором энергетическом уровне.
Таким образом, у бериллия - 2 электрона на внешнем энергетическом уровне, у магния - также 2 электрона, у кальция - 2 электрона, у стронция - 2 электрона, у бария - 2 электрона, а у радия - 2 электрона.
Присутствие двух электронов на внешнем энергетическом уровне позволяет щелочноземельным металлам проявлять определенные химические свойства, такие как образование ионов с положительным зарядом при потере этих электронов.
Вопрос-ответ

Какое количество электронов на внешнем энергетическом уровне имеют атомы щелочноземельных металлов?
Они имеют 2 электрона на внешнем энергетическом уровне.
Сколько электронов распределено на внешнем энергетическом уровне у атомов щелочноземельных металлов?
Всегда имеется 2 электрона на внешнем энергетическом уровне у атомов щелочноземельных металлов.
Почему число электронов на внешнем энергетическом уровне атомов щелочноземельных металлов всегда равно 2?
Это обуславливается особенностями строения электронной оболочки атомов щелочноземельных металлов, где на внешнем энергетическом уровне всегда находятся два электрона.
Может ли число электронов на внешнем энергетическом уровне атомов щелочноземельных металлов быть отличным от 2?
Нет, число электронов на внешнем энергетическом уровне атомов щелочноземельных металлов всегда равно 2.
Какова особенность числа электронов на внешнем энергетическом уровне у атомов щелочноземельных металлов?
Они имеют постоянное число электронов на внешнем энергетическом уровне, и оно всегда равно 2.
