В периодической системе химических элементов между периодами и комплектами электронов наблюдаются закономерности, которые позволяют судить о строении атомов различных элементов. Металлы главной подгруппы периодической системы обладают своеобразным расположением электронов на своих внешних энергетических уровнях.
В атомах металлов главной подгруппы, таких как алюминий (Al), галий (Ga), индий (In), таллий (Tl), свинец (Pb) и полоний (Po), на их внешнем энергетическом уровне находится 1 или 2 электрона. Это обусловлено их расположением в таблице Менделеева - они находятся на s- и p-орбиталях, которые насчитывают 2 и 6 электронов соответственно.
Такое количество электронов на внешнем энергетическом уровне в атомах металлов главной подгруппы имеет важное значение для их химических свойств. Оно определяет способность данных элементов к образованию соединений и взаимодействию с другими веществами. Например, атомы алюминия и галлия, у которых на внешнем уровне находится 3 электрона, более активны по сравнению с атомами индия, таллия, свинца и полония, у которых на внешнем уровне только 1 или 2 электрона. Это определяет их возможность образовывать химические связи и сферические комплексы.
Количество электронов и их расположение в атомах металлов

Количество электронов на внешнем энергетическом уровне в атомах металлов главной подгруппы периодической системы определяет их химические свойства. В металлах, принадлежащих к первой подгруппе (группа 1A), на внешнем энергетическом уровне содержится один электрон. Это делает их очень реакционноспособными, так как они готовы отдать этот электрон и образовать ион положительного заряда.
Металлы главной подгруппы периодической системы, принадлежащие ко второй подгруппе (группа 2A), имеют два электрона на внешнем энергетическом уровне. Их химические свойства в значительной мере определяются именно этими двумя электронами. Они часто образуют ионы с двойным положительным зарядом, отдавая оба этих электрона.
У металлов главной подгруппы периодической системы, принадлежащих к третьей подгруппе (группа 3B), на внешнем энергетическом уровне находится от 1 до 3 электронов. Именно эти электроны определяют их химическую активность. Эти металлы часто образуют различные ионы, в зависимости от количества электронов, которые они готовы отдать.
Энергетические уровни и их значения
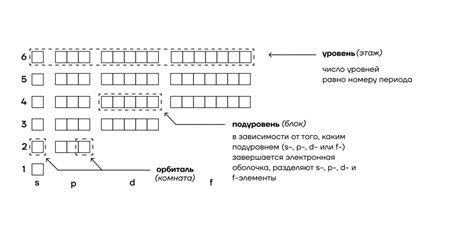
Атомы металлов главной подгруппы периодической системы имеют особый строение энергетических уровней. Основными энергетическими уровнями в таких атомах являются s-, p-, d- и f-орбитали. Каждый энергетический уровень может содержать определенное количество электронов, определяемое правилом максимального заполнения энергетических уровней.
На первом энергетическом уровне (s-орбитали) может находиться максимум 2 электрона. Этот энергетический уровень наиболее близкое к ядру и имеет минимальную энергию.
На втором энергетическом уровне (p-орбитали) может находиться максимум 6 электронов. Этот уровень уже находится немного дальше от ядра и имеет большую энергию.
На третьем энергетическом уровне (d-орбитали) может находиться максимум 10 электронов. Этот энергетический уровень имеет еще большую энергию и находится еще дальше от ядра.
На самом последнем энергетическом уровне (f-орбитали) может находиться максимум 14 электронов. Этот энергетический уровень наиболее далек от ядра и имеет самую высокую энергию.
Таким образом, количество электронов на внешнем энергетическом уровне в атомах металлов главной подгруппы периодической системы зависит от энергетического уровня, на котором они находятся, и может изменяться от 1 до 14.
Особенности энергетических уровней главной подгруппы периодической системы

Энергетические уровни атомов металлов главной подгруппы периодической системы имеют свои особенности, которые определяют их химические свойства и внешний вид.
Первая особенность заключается в том, что на внешнем энергетическом уровне атомов металлов главной подгруппы находится от одного до трёх электронов. Эти электроны играют ключевую роль в химических реакциях и взаимодействии атомов с другими веществами.
Вторая особенность связана с расположением этих уровней относительно ядра атома. Энергетические уровни главной подгруппы расположены ближе к ядру, чем уровни атомов других элементов. Это обусловлено более сложной структурой электронной оболочки у атомов металлов главной подгруппы.
Третья особенность связана с количеством электронов на внешнем энергетическом уровне. Как уже было упомянуто, на этом уровне находится от одного до трёх электронов. Это обусловлено тем, что атомы металлов главной подгруппы стремятся достигнуть стабильной электронной конфигурации, заполнив последний энергетический уровень.
Из-за этих особенностей энергетических уровней атомов металлов главной подгруппы они обладают высокой активностью в химических реакциях и легко взаимодействуют с другими элементами. Благодаря этому металлы главной подгруппы широко применяются в различных отраслях промышленности и технологий.
Как расположены электроны на внешнем энергетическом уровне
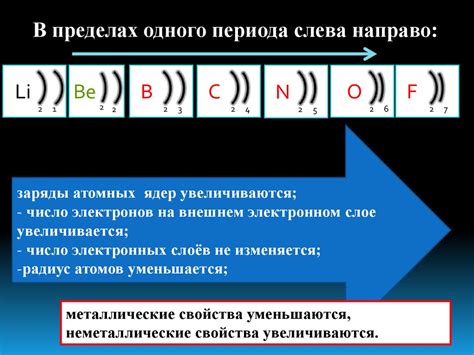
У атомов металлов главной подгруппы периодической системы количество электронов на внешнем энергетическом уровне может быть разным. В каждой главной подгруппе оно увеличивается на один, начиная с первой главной подгруппы, в которой на внешнем уровне находится только один электрон. Например, у атомов металлов из второй главной подгруппы на внешнем уровне находятся два электрона.
Расположение электронов на внешнем энергетическом уровне имеет особое значение для свойств металлов. Эти электроны играют важную роль в образовании химических связей и в определении химической активности элемента. Число электронов на внешнем энергетическом уровне также определяет валентность атома металла.
Наличие свободных электронов на внешнем энергетическом уровне делает металлы отличными проводниками электричества и тепла. Свободные электроны могут свободно перемещаться по кристаллической решетке и создавать электрический ток. Это объясняет высокую электропроводность металлов.
Количество электронов на внешнем энергетическом уровне также влияет на внутреннюю структуру и электронную конфигурацию атомов металлов. Валентный электрон может участвовать в образовании ковалентных связей с другими атомами, образуя многие разнообразные соединения и соединительные линии, которые дополняют основную структуру кристаллической решетки.
Роль внешнего энергетического уровня в свойствах металлов

Внешний энергетический уровень играет ключевую роль в определении свойств металлов главной подгруппы периодической системы. Количество электронов на этом уровне определяет химическую активность, электропроводность и многие другие характеристики металлов.
На внешнем энергетическом уровне находятся валентные электроны металла. Они участвуют в химических реакциях и обеспечивают связывание с другими атомами. Количество валентных электронов определяет химическую активность металла: чем больше валентных электронов, тем больше возможностей для образования химических связей.
Кроме того, наличие свободных электронов на внешнем уровне делает металлы отличными проводниками электричества. Свободные электроны мобильны и свободно передвигаются внутри металлической структуры, обеспечивая высокую электропроводность. Это также делает металлы хорошими проводниками тепла и делает их блестящими и отражающими свет.
Также, количество электронов на внешнем энергетическом уровне влияет на физические свойства металлов, такие как пластичность и хрупкость. Интересное явление наблюдается при переходе через постоянный переход от металлов главной подгруппы периодической системы к металлам побочных: со снижением количества электронов на внешнем уровне изменилась структура кристаллической решетки и повысились вяжущие и механические свойства.
Влияние внешнего энергетического уровня на химическую активность

Внешний энергетический уровень, определяющий количество электронов на внешней оболочке атома, играет важную роль в химической активности металлов главной подгруппы периодической системы. Этот параметр определяет способность атома образовывать химические связи с другими атомами и участвовать в химических реакциях.
Металлы главной подгруппы периодической системы имеют от одного до трех электронов на внешнем энергетическом уровне. Эти электроны называются валентными электронами и определяют химическую активность атома. Чем меньше электронов на внешней оболочке, тем больше потенциала атома для образования химических связей.
Например, атомы алкалийных металлов главной подгруппы, таких как натрий и калий, имеют один валентный электрон на внешнем энергетическом уровне. Этот электрон легко отделяется от атома и образует положительный ион, что делает эти металлы химически активными. Они активно реагируют с водой, кислородом и другими веществами.
В случае металлов второй и третьей группы периодической системы, таких как магний и алюминий, на внешнем энергетическом уровне находятся два или три валентных электрона соответственно. Это значительно снижает химическую активность данных металлов, так как требуется больше энергии для отделения валентных электронов от атома.
Таким образом, внешний энергетический уровень определяет химическую активность атома металла главной подгруппы периодической системы. Чем меньше электронов на внешней оболочке, тем больше потенциала атома для образования химических связей и участия в химических реакциях.
Вопрос-ответ

Какое количество электронов на внешнем энергетическом уровне имеют атомы металлов главной подгруппы периодической системы?
Атомы металлов главной подгруппы периодической системы имеют от 1 до 3 электронов на их внешнем энергетическом уровне.
Сколько электронов на внешнем энергетическом уровне содержатся у атомов металлов главной подгруппы периодической системы?
На внешнем энергетическом уровне атомов металлов главной подгруппы периодической системы содержится от 1 до 3 электронов.
Каким образом распределены электроны на внешнем энергетическом уровне у атомов металлов главной подгруппы периодической системы?
Электроны на внешнем энергетическом уровне атомов металлов главной подгруппы периодической системы распределены следующим образом: первая подгруппа имеет 1 электрон, вторая - 2 электрона, третья - 3 электрона.
Почему атомы металлов главной подгруппы периодической системы имеют разное количество электронов на внешнем энергетическом уровне?
Количество электронов на внешнем энергетическом уровне у атомов металлов главной подгруппы периодической системы зависит от их будущих химических свойств и реакций. Для устойчивости и получения полностью заполненной оболочки атом стремится иметь 8 электронов (правило октаэдра). В случае атомов главной подгруппы периодической системы, количество электронов на внешней оболочке может быть от 1 до 3, чтобы достичь приближенной к устойчивости состояния.
Какое значение имеют электроны на внешнем энергетическом уровне у атомов металлов главной подгруппы периодической системы для их химической активности?
Электроны на внешнем энергетическом уровне у атомов металлов главной подгруппы периодической системы имеют значение для их химической активности, так как они участвуют в химических реакциях, образуя химические связи с другими атомами. Количество электронов на внешнем энергетическом уровне определяет возможность атома металла образовывать связи и вступать в реакции с другими элементами.
