Электронное строение атомов щелочных металлов определяется количеством электронов на их внешнем энергетическом слое. Щелочные металлы, такие как литий, натрий и калий, относятся к первой группе периодической системы элементов. У них одно общее свойство - наличие одного электрона на внешнем энергетическом слое. Этот электрон может быть легко потерян, что делает щелочные металлы хорошими элементами для создания ионов положительных зарядов.
У атомов лития, натрия и калия на внешнем энергетическом слое находятся, соответственно, 2s^1, 3s^1 и 4s^1 электронов. Такое электронное строение позволяет легко отделять один электрон и создавать ионы щелочных металлов с положительной зарядой +1. Это объясняет их активность и способность образовывать ионные связи с другими элементами.
Важно отметить, что электронное строение атомов щелочных металлов может варьироваться в зависимости от их ионизационной энергии. Например, атомы лития, натрия и калия могут потерять свой внешний электрон и образовать ионы +1 заряда. Однако в более высоких энергетических уровнях могут находиться и другие электроны, которые будут иметь важное значение для химических свойств этих элементов.
Что такое электронное строение атомов
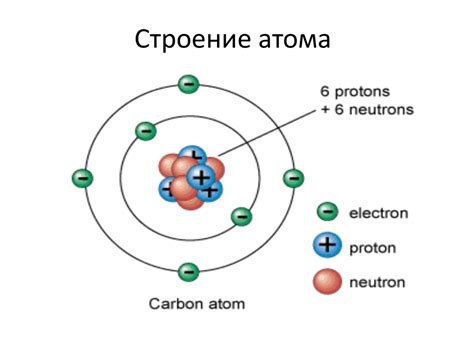
Электронное строение атомов - это описание расположения электронов в энергетических оболочках вокруг ядра атома. В атоме электроны находятся на разных энергетических уровнях, которые называются оболочками или слоями.
Наиболее удаленная от ядра оболочка, называемая внешней оболочкой, играет особенно важную роль. Взаимодействуя с другими атомами, атомы стремятся постичь более стабильное состояние, заполняя внешнюю оболочку электронами. Количество электронов на внешнем энергетическом слое влияет на химические свойства атомов.
Щелочные металлы являются элементами, которые находятся в первой группе периодической системы и имеют один электрон на внешнем энергетическом слое. Именно это единственное электронное состояние делает щелочные металлы химически активными и склонными к образованию ионов с положительным зарядом.
Электронное строение атомов щелочных металлов определяет их реактивность и способность образовывать химические связи с другими элементами. Это свойство щелочных металлов является основой для их широкого использования в различных областях науки и техники.
Электронное строение атомов щелочных металлов

Щелочные металлы являются элементами первой группы периодической системы химических элементов. Их атомы имеют особое электронное строение, которое определяется положением этих элементов в периодической системе.
На внешнем энергетическом слое атома щелочного металла находится один электрон. Это делает их атомы очень активными химическими элементами, так как внешний электрон легко отделяется и образует ион с положительным зарядом. В результате этого, атомы щелочных металлов проявляют сильную реакционную способность и быстро реагируют с другими элементами.
Электронное строение атома щелочного металла можно представить следующим образом: на внутренних энергетических слоях находятся полностью заполненные оболочки с собственным числом электронов, а на внешнем слое находится один электрон. Такое строение определяет физические и химические свойства этих элементов.
Например, на первом энергетическом уровне (уровне K) атом лития содержит 2 электрона, первый электрон занимает s-орбиталь, а второй электрон занимает p-орбиталь. Атом натрия на внешнем энергетическом слое имеет 11 электронов, из которых первый электрон занимает s-орбиталь, а остальные десять электронов занимают p-орбитали.
Таким образом, электронное строение атомов щелочных металлов определяет их активность и способность образовывать соединения с другими элементами.
Как определить количество электронов на внешнем энергетическом слое

Электронное строение атомов щелочных металлов, таких как литий, натрий, калий и др., имеет свои особенности. Чтобы определить количество электронов на внешнем энергетическом слое, необходимо взглянуть на периодическую таблицу элементов.
В периодической таблице элементов атомы расположены согласно возрастанию порядкового номера. Например, литий имеет порядковый номер 3, а натрий - 11. Отсюда следует, что у лития на внешнем энергетическом слое находится 1 электрон, а у натрия - 2 электрона.
В целом, электронное строение атомов щелочных металлов характеризуется наличием 1 электрона на внешнем энергетическом слое, что делает их очень реактивными и ионизирующими элементами.
Для более точного определения количества электронов на внешнем энергетическом слое можно использовать формулу, называемую правилом Хунда. Согласно этому правилу, электроны заполняют энергетические уровни поочередно, прежде чем заполнять пустые подуровни. Это означает, что на внешнем энергетическом слое максимально может находиться 8 электронов.
Но применение правила Хунда не всегда приводит к определенному количеству электронов на внешнем слое щелочных металлов, так как эти элементы обладают неполной внешней оболочкой электронов. Это явление объясняется перескоком электрона с n-1 энергетического уровня на n-2 уровень, чтобы обеспечить большую стабильность атома за счет полного заполнения внешнего слоя. Именно поэтому щелочные металлы обладают большим реакционным потенциалом и готовностью отдавать внешний электрон.
Примеры электронного строения щелочных металлов

Щелочные металлы состоят из одного электрона на внешнем энергетическом слое своего атома. Этот электрон называется валентным электроном и именно его свойства определяют химические свойства и реактивность щелочных металлов. Возьмем для примера натрий (Na) и калий (K), два наиболее известных щелочных металла.
У атома натрия имеется два энергетических слоя: первый слой заполнен двумя электронами, а на втором слое находится один валентный электрон. Таким образом, электронная конфигурация атома натрия будет выглядеть как: 2-8-1. Калий имеет три энергетических слоя, первый заполнен двумя электронами, второй - восьми электронами, а на третьем слое находится один валентный электрон. То есть электронная конфигурация атома калия: 2-8-8-1.
Этот один валентный электрон, находящийся на внешнем энергетическом слое, делает щелочные металлы очень реактивными. Они стремятся отдать этот электрон и образовать положительный ион. Именно поэтому щелочные металлы легко реагируют с другими элементами, создавая соли и прочие химические соединения.
По своей природе щелочные металлы очень активны и реактивны, поэтому их не находят в свободном состоянии в природе, они всегда находятся в соединениях. Примеры таких соединений включают соль (NaCl), гидроксид натрия (NaOH) и множество других соединений, которые используются в различных отраслях промышленности и научных исследованиях.
Почему количество электронов на внешнем энергетическом слое важно
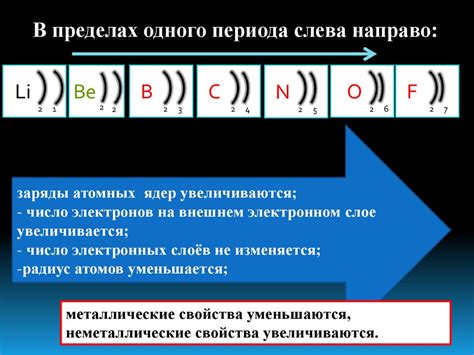
Количество электронов на внешнем энергетическом слое является одним из основных параметров, определяющих химические свойства атомов щелочных металлов. Внешний энергетический слой включает электронный пассивный оболочечный слой и активные электронные подуровни. Основной электронный слой отвечает за главнобочные энергетические уровни, на которых расположены внешние электроны, выходные электроны.
Количество электронов на внешнем слое определяет химическую активность щелочных металлов. Благодаря наличию одного электрона на внешнем слое, щелочные металлы обладают высокой реакционной способностью. Они стремятся отдать свой единственный электрон, чтобы достичь стабильности путем заполнения внешней оболочки с максимальным числом электронов. Поэтому щелочные металлы легко образуют катионы и формируют химические связи с другими элементами, такими как кислород, водород и галогены.
Количество электронов на внешнем слое также влияет на физические свойства атомов щелочных металлов. Например, это количество прямо пропорционально размеру атома или иона. Малые атомы имеют высокую плотность заряда на внешней оболочке из-за малого размера; это приводит к большим электронным притяжению и более сильной ионной связи в соединениях. Большое количество электронов на внешнем слое также способствует формированию металлической связи, что делает щелочные металлы хорошими проводниками электричества и тепла.
Понимание количества электронов на внешнем энергетическом слое является ключевым для понимания химических и физических свойств атомов щелочных металлов и позволяет более эффективно применять их в различных областях, включая химическую промышленность, электронику и энергетику.
Вопрос-ответ

Сколько электронов на внешнем энергетическом слое у щелочных металлов?
У щелочных металлов на внешнем энергетическом слое находится один электрон.
Каково электронное строение щелочных металлов?
У щелочных металлов электронная конфигурация заканчивается на s-подуровне, и на внешнем энергетическом слое находится один электрон.
