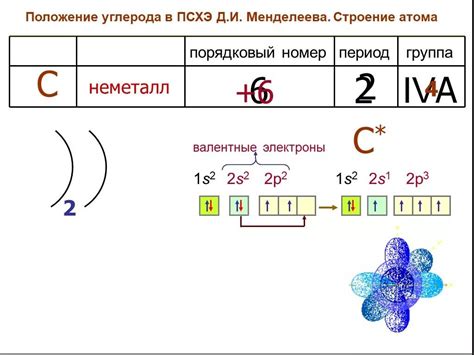
Структура атома металла является основополагающей для его химических и физических свойств. Одним из ключевых параметров, определяющих характер взаимодействия атома металла с другими веществами, является число электронов на его внешнем электронном уровне. В данной статье рассмотрим важные особенности этого числа и его значимость для химической активности металлов.
Внешний электронный уровень атома металла, также известный как валентный электронный уровень, содержит последние электроны в электронной конфигурации атома. Число электронов на этом уровне играет существенную роль в химических реакциях, так как именно эти электроны участвуют в обмене или передаче электронов при образовании химических связей. Число электронов на внешнем электронном уровне определяет валентность атома металла и его способность образовывать химические соединения с другими атомами.
У металлов число электронов на внешнем электронном уровне часто составляет 1, 2 или 3. Это связано с их положением в периодической системе элементов. Например, восемь проекции металлов на периодической системе завершается p-блоком элементов, в котором электронная конфигурация включает 8 электронов на внешнем электронном уровне. В свою очередь, элементы переходных металлов имеют d-блок, в котором электронная конфигурация содержит 9 или 10 электронов на внешнем электронном уровне. Эти особенности числа электронов на внешнем электронном уровне сильно влияют на физические и химические свойства металлов.
Определение внешнего электронного уровня

Внешний электронный уровень атома металла играет важную роль в его химических свойствах. На этом уровне находятся электроны, которые являются самыми далекими от ядра и наиболее доступными для взаимодействия с другими атомами. Определение этого уровня позволяет лучше понять и объяснить химическое поведение металлов.
Внешний электронный уровень можно определить на основе расположения элементов в таблице химических элементов. Для большинства металлов внешний электронный уровень имеет обозначение s или p, и их количество электронов на этом уровне определяется номером группы элемента в периодической таблице. Например, у металлов скандия и циркония на внешнем уровне находятся 2 электрона.
Однако, у некоторых металлов внешний электронный уровень может быть сложным и включать как s, так и d или f-электроны. Например, у атома меди внешний электронный уровень представлен 3d^10 и 4s^1 электронами. Это связано с особенностями электронной конфигурации и позволяет металлу проявлять интересные физико-химические свойства.
Знание числа электронов на внешнем электронном уровне помогает в понимании взаимодействия атомов металла с другими элементами при образовании химических соединений. Изменение числа электронов на этом уровне может привести к образованию ионов металла с различной зарядностью, что влияет на его активность и реакционную способность.
Значение внешнего электронного уровня атома
Внешний электронный уровень атома играет важную роль в его химических свойствах и реактивности. Он определяет, как атом будет взаимодействовать с другими атомами и молекулами.
Количество электронов на внешнем электронном уровне атома металла называется валентностью. Валентные электроны могут участвовать в образовании химических связей и определять химическую активность атома. Часто металлы имеют несколько внешних электронных уровней, и количество валентных электронов может меняться в зависимости от конкретной ситуации.
Валентные электроны на внешнем электронном уровне металла обычно расположены в орбиталях s и p. Орбитали s могут содержать до 2 электронов, а орбитали p - до 6 электронов. Таким образом, общее количество валентных электронов может быть от 1 до 8. Это определяет способность металла образовывать связи с другими атомами и участвовать в химических реакциях.
Значение внешнего электронного уровня атома металла также может влиять на его физические свойства, такие как теплопроводность и электропроводность. Валентные электроны обычно свободно двигаются по сетке кристаллической решетки металла, что позволяет проводить электрический ток. Большое количество валентных электронов может значительно увеличить электропроводность металла.
Как определить внешний электронный уровень атома
Внешний электронный уровень атома играет важную роль в химической реактивности и свойствах веществ. Определить количество электронов на внешнем электронном уровне поможет нам понять, как атом будет взаимодействовать с другими атомами и молекулами и какие связи он может образовывать.
Для определения внешнего электронного уровня атома необходимо изучить его электронную конфигурацию. Электронная конфигурация состоит из набора электронных орбиталей, находящихся на разных энергетических уровнях. Внешний электронный уровень обычно находится на самом высоком энергетическом уровне.
Чтобы определить количество электронов на внешнем электронном уровне, можно использовать таблицу Менделеева. Для атомов, находящихся в периодической системе блоке s и p, номер периода означает количество электронов на внешнем электронном уровне. Например, атом элемента из пятого периода будет иметь 5 электронов на внешнем электронном уровне.
В случае атомов, находящихся в блоках d и f, определение внешнего электронного уровня немного сложнее. Для этого нужно учитывать электронную конфигурацию каждого атома и заполнение орбиталей d- и f-блоков.
Имея информацию о внешнем электронном уровне атома, можно понять, какие реакции и связи может образовать данный элемент. Например, атом, имеющий один электрон на внешнем электронном уровне, будет стремиться отдать его, образуя положительный ион. Атом, имеющий 7 электронов на внешнем электронном уровне, будет стремиться принять один электрон, образуя отрицательный ион.
Металлы и их электронная структура
Металлы - это класс элементов, характеризующихся особыми физическими и химическими свойствами. Одной из важных характеристик металлов является их электронная структура, которая определяет их химическую активность и способность образовывать связи с другими элементами.
Электронная структура металлов отличается от электронной структуры других элементов. Внешний электронный уровень металла, также называемый валентным уровнем, обычно содержит только несколько электронов. Эти электроны находятся в свободном состоянии и способны двигаться по всей структуре металла. Это явление называется "мобильностью электронов" и является одной из причин, почему металлы обладают хорошей электропроводностью и теплопроводностью.
Внешние электроны металла играют ключевую роль в химических реакциях. Они могут образовывать связи с другими элементами, образуя ионы или соединения. Количество внешних электронов на валентном уровне варьирует от металла к металлу, и это определяет их химические свойства и способность образовывать различные соединения.
Металлы могут образовывать различные структуры, включая кристаллические решетки, в которых металлические ионы окружены облаком электронов. Эти электроны играют важную роль в формировании металлических связей и обеспечивают металлам их особые физические свойства, такие как пластичность и деформируемость.
Изучение электронной структуры металлов позволяет более глубоко понять их химические и физические свойства и применить эту информацию в различных областях науки и технологии, включая материаловедение, электронику и катализ.
Что такое атом металла
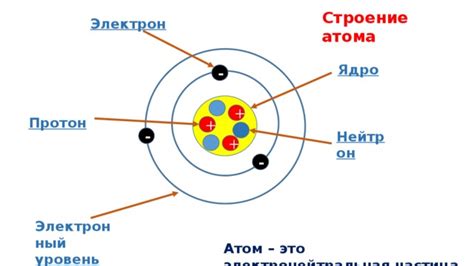
Атом металла - это основная структурная единица металлического элемента, которая состоит из положительно заряженного ядра и окружающих его электронов. Ядро атома содержит протоны и нейтроны, а внешний электронный оболочка находятся электроны. Число электронов на внешнем электронном уровне определяет химические и физические свойства металла.
Атомы металлов имеют обычно от одного до трех электронов на внешнем электронном уровне. Это позволяет им образовывать связи с другими атомами и образовывать кристаллическую решетку, что обуславливает их характерные свойства, такие как термическая и электрическая проводимость, пластичность и гибкость.
Атомы металлов также могут образовывать ионы, потеряв или получив электроны, что позволяет им проявлять свойства металлических катионов и анионов. Ионы металлов используются во многих процессах, таких как электролиз, гальваническое покрытие и синтез различных соединений.
Особенности электронной структуры металлических атомов

Электронная структура металлических атомов представляет особый интерес для изучения свойств металлов. Она определяет многое: от химических свойств до электрической и тепловой проводимости. Главной особенностью электронной структуры металлических атомов является наличие свободных электронов на внешнем электронном уровне.
В отличие от атомов неметаллов, у которых внешние электронные оболочки обычно заполнены, металлические атомы имеют несколько свободных электронов на своем внешнем электронном уровне. Это позволяет им образовывать межатомные связи в кристаллической решетке и обеспечивает высокую подвижность электронов в металле.
Свободные электроны обладают значительной подвижностью и могут перемещаться по кристаллической решетке металла. Это объясняет одно из важнейших свойств металлов - их высокую электрическую и тепловую проводимость. Благодаря свободным электронам, металлы могут эффективно переносить электрический ток и тепло.
Также, наличие свободных электронов делает металлы относительно мягкими и хорошо поддающимися обработке. Свободные электроны способны "смазывать" движение атомов в металле, что придает ему пластичность и способность быть легко деформированным без разрушения кристаллической решетки.
Атом металла и его внешний электронный уровень

Атом металла состоит из ядра и облака электронов, которое окружает его. Один из важных параметров атома металла - это число электронов на его внешнем электронном уровне. Влияние этого числа на свойства металла является одним из ключевых моментов в химии.
Внешний электронный уровень атома металла определяет его реактивность и способность образовывать связи с другими атомами. Число электронов на внешнем уровне также определяет степень восприимчивости металла к окружающей среде, его проводимость и электрохимические свойства.
Чаще всего внешний электронный уровень атома металла насчитывает от 1 до 3 электронов. Эти электроны могут быть легко отданы или приняты при химических реакциях, что обуславливает металлическую связь и множество других свойств металлов.
Например, в металлах с одним электроном на внешнем уровне, таких как натрий или калий, протекание электрического тока обуславливается передвижением электрона по кристаллической решетке металла. В то же время, в металлах с двумя или тремя электронами на внешнем уровне, например, магнии или алюминии, образуется более сложная структура электронного облака, что влияет на их физические свойства, такие как плотность и температура плавления.
Связь внешнего электронного уровня атома металла с его свойствами

Внешний электронный уровень атома металла играет ключевую роль в определении его свойств. Количество электронов на внешнем электронном уровне определяет способность атома металла образовывать химические связи с другими атомами и влияет на его реакционную способность.
Электроотрицательность атома металла, связанная с его внешним электронным уровнем, определяет его способность отдавать электроны и образовывать катионы. Чем меньше количество электронов на внешнем электронном уровне, тем меньше энергии требуется для их отдачи, что делает атом металла более реакционноспособным.
Свободные электроны на внешнем электронном уровне атома металла обеспечивают его электропроводность. При наличии свободных электронов, атомы металла могут образовывать электронные переходы и обеспечивать передачу электрического тока. Эта особенность атома металла обусловливает его использование в различных электронных и электрических устройствах и материалах.
Также количество электронов на внешнем электронном уровне влияет на температуру плавления и кипения металла. Металлы с более высоким количеством электронов на внешнем электронном уровне имеют более высокую температуру плавления и кипения, так как требуется больше энергии для преодоления электрических сил притяжения между атомами.
Изучение внешнего электронного уровня атома металла позволяет понять многие его физические и химические свойства, что важно для использования металлов в различных отраслях промышленности и науки.
Какие элементы обладают полностью заполненным внешним электронным уровнем

Внешний электронный уровень атома металла может быть полностью заполнен электронами, что влияет на его химические свойства и роль в реакциях. Какие элементы обладают таким заполненным уровнем?
Во-первых, это группа инертных газов – гелий, неон, аргон, криптон, ксенон и радон. По типу внешних электронов они относятся к сферическому s-блоку и имеют одну, две или восемь парных электронов на внешнем s-субуровне. Эти элементы обладают высокой стабильностью и не образуют химические соединения с другими элементами, за исключением некоторых экстремальных условий.
Кроме инертных газов, полностью заполненный внешний электронный уровень имеют черный и железо. Эти элементы относятся к d-блоку и имеют по шесть электронов на внешнем d-субуровне. Из-за этого они обладают подобными химическими свойствами и способны образовывать соединения с другими элементами.
Наиболее интересным является полностью заполненный внешний электронный уровень у металла олово, который относится к p-блоку. Олово имеет четыре электрона в внешнем p-субуровне, что дает ему возможность образовывать множество химических соединений, включая оловянные соли и органические соединения. Олово также используется в производстве различных материалов и сплавов благодаря своим проводящим и антикоррозионным свойствам.
Важная роль внешнего электронного уровня в химических реакциях

Внешний электронный уровень атома металла играет важную роль в химических реакциях. Этот электронный уровень содержит в своей оболочке электроны, которые могут активно взаимодействовать с другими атомами и ионами. Это позволяет металлам образовывать различные соединения и участвовать во многих химических процессах.
Внешний электронный уровень атома металла можно представить как облако электронов, которые легко выходят из атома и участвуют в химических реакциях. Эти электроны могут быть переданы другим атомам, образуя ионы, или образовывать связи с электронами других атомов, образуя координационные связи.
Имея в своей оболочке несколько электронов на внешнем уровне, атомы металла могут образовывать сложные структуры, такие как кластеры и полимеры. Это позволяет им обладать разнообразными свойствами и использоваться в различных отраслях промышленности.
Кроме того, внешний электронный уровень атома металла определяет его химическую активность. Металлы с большим числом электронов на внешнем уровне обычно являются активными химическими элементами, способными вступать во взаимодействия с другими веществами. Это делает их важными катализаторами, материалами для проводников электричества и другими веществами, широко используемыми в технологических процессах.
Вопрос-ответ

Что представляет собой внешний электронный уровень атома металла?
Внешний электронный уровень атома металла - это самый высокоэнергетический уровень в электронной оболочке атома, на котором находятся электроны, участвующие в химических реакциях и связывании с другими атомами. Количество электронов на внешнем электронном уровне определяет химические и физические свойства металла.
Как определяется количество электронов на внешнем электронном уровне атома металла?
Количество электронов на внешнем электронном уровне атома металла может быть определено по номеру группы атома в периодической системе элементов. Например, атомы металлов из 1 группы имеют 1 электрон на внешнем уровне, а из 2 группы - 2 электрона. Однако, есть некоторые исключения, например, атомы металлов переходных элементов имеют переменное количество электронов на внешнем электронном уровне.
