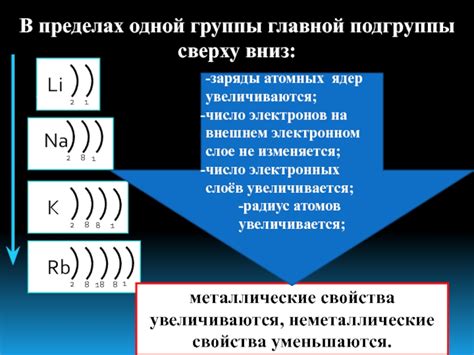
В химии существует две основные категории элементов - металлы и неметаллы. Одно из основных различий между ними заключается в количестве электронов, находящихся на последнем энергетическом уровне.
Металлы, в основном, имеют от одного до трех электронов на последнем энергетическом уровне. Это делает их отличными проводниками электричества и тепла. Большинство металлов обладает малой электроотрицательностью и способны легко отдавать электроны. Это объясняет их способность образовывать ионы положительной заряды.
В отличие от металлов, неметаллы имеют от четырех до восьми электронов на последнем энергетическом уровне. Они обладают большой электроотрицательностью и обычно принимают электроны от других элементов. Неметаллы, как правило, не могут проводить электричество, так как электроны на их последнем энергетическом уровне сильно связаны и сложно отдавать или принимать электроны.
Интересный факт: в периодической системе химических элементов, металлы расположены на левом краю, а неметаллы - на правом краю. Поэтому, при изучении свойств элементов, знание их числа электронов на последнем энергетическом уровне является первостепенной важностью. Это позволяет лучше понять их реакционную способность и химические свойства.
Различия в числе электронов на последнем уровне: металлы и неметаллы

Металлы и неметаллы - это две основные категории элементов в периодической системе. Одной из основных различий между ними является число электронов на последнем (валентном) энергетическом уровне.
Металлы обычно имеют несколько электронов на последнем энергетическом уровне. Это делает их склонными к образованию положительно заряженных ионов, так как они готовы отдать одно или несколько своих электронов при реакции с другими элементами. Это часто связано с их способностью образовывать металлическую связь и проводить электричество и тепло.
Неметаллы, с другой стороны, обычно имеют недостаток электронов на последнем энергетическом уровне. Это заставляет их быть более объединенными в твердом состоянии и образовывать ковалентные или ионные связи с другими элементами. Неметаллы также могут быть плохими проводниками электричества и тепла.
Число электронов на последнем уровне играет важную роль в определении физических и химических свойств элементов. Наличие или отсутствие свободных электронов в валентной оболочке может определять их реактивность, способность к образованию связей и свойства вещества.
Таким образом, различия в числе электронов на последнем энергетическом уровне между металлами и неметаллами оказывают значительное влияние на их физические и химические свойства и определяют их поведение в реакциях и соединениях.
Металлы имеют более низкое число электронов на последнем уровне

Металлы - это элементы, которые обладают характеристиками, позволяющими им образовывать положительные ионы. Они обладают особенной структурой атома, где на последнем энергетическом уровне находится меньшее количество электронов. Это число электронов на последнем уровне прямо связано с хорошей проводимостью электричества, одним из главных свойств металлов.
На последнем энергетическом уровне у металлов находится малое количество электронов, что делает их валентных электронов более доступными для взаимодействия с другими атомами. Это свойство позволяет металлам проявлять химическую активность, так как они легко передают электроны другим атомам и образуют позитивные ионы. В результате металлы имеют способность образовывать химические соединения с другими элементами.
Металлы также обладают особым процессом, известным как деформация, который возникает благодаря свободному движению электронов на последнем энергетическом уровне. Это позволяет металлам изменять свою форму и структуру без разрушения. Электроны на последнем уровне металлов играют важную роль в создании межатомных связей и обуславливают специфические свойства металлов, такие как металлический блеск, хорошая проводимость тепла и электричества.
Неметаллы, в свою очередь, имеют более высокое число электронов на последнем уровне, что определяет их атомные свойства. Они обладают более высокой электроотрицательностью, что делает их неспособными к передаче электронов другим атомам. Вместо этого неметаллы склонны принимать или делить электроны с другими атомами, чтобы образовать стабильные химические соединения. Это явление также объясняет некоторые свойства неметаллов, например, их способность к образованию ковалентных связей и интересные электронные конфигурации.
Неметаллы имеют более высокое число электронов на последнем уровне
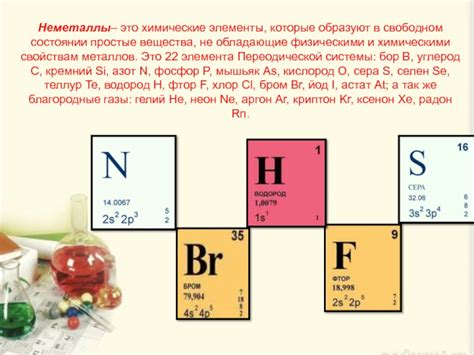
Неметаллы – это группа химических элементов, которая обладает такими свойствами, как отсутствие металлического блеска, низкая теплопроводность и электропроводность, и, что самое главное, большое число электронов на последнем энергетическом уровне.
В атоме неметалла, последний энергетический уровень наполняется электронами до определенного количества. Это количество электронов на последнем энергетическом уровне определяет химические свойства элемента и его способность образовывать химические связи.
Поскольку неметаллы имеют большое число электронов на последнем энергетическом уровне, они имеют высокую электронную плотность, что обуславливает их высокую реакционную способность. Благодаря этому они образуют химические соединения с другими элементами, включая металлы, и выступают в качестве окислителей или восстановителей в химических реакциях.
Неметаллы образуют разнообразные соединения с металлами, например, соли. Они способны принимать или отдавать электроны, чтобы достичь стабильного энергетического состояния, что позволяет им образовывать химические связи с металлами и другими неметаллами.
Таким образом, высокое число электронов на последнем энергетическом уровне является одним из главных отличий неметаллов от металлов и определяет их химические свойства и реакционную способность.
Металлы формируют положительные ионы

Металлы, в отличие от неметаллов, имеют малое количество электронов на последнем энергетическом уровне. Это делает их более склонными к потере электронов и образованию положительных ионов.
При взаимодействии металлических элементов с неметаллами происходит трансфер электронов и образуется ионная связь. Металлический элемент отдает один или несколько электронов от последнего энергетического уровня, становясь положительно заряженным ионом, который называется катионом.
Формирование положительных ионов металлами обусловлено их стремлением достичь более стабильной электронной конфигурации. После потери электрона энергетический уровень последней оболочки металла становится полностью заполненным, что придает атому большую стабильность.
Катионы металлов обладают положительной зарядой и обычно образуют кристаллические решетки в металлических соединениях, таких как металлы и их сплавы. Катионы металлов также способствуют проводимости электричества и тепла в металлических материалах.
Ионные связи между металлическими и неметаллическими элементами существуют во многих соединениях, таких как соли, оксиды и сульфиды. Формирование положительных ионов металлами играет важную роль во многих химических и физических свойствах металлов и обуславливает их широкое использование в различных отраслях промышленности и технологии.
Неметаллы формируют отрицательные ионы

Одним из основных отличий неметаллов от металлов является способность неметаллов формировать отрицательные ионы.
Когда неметалл вступает в химическую реакцию с другими элементами, он может принять один или несколько электронов от других атомов, чтобы достичь стабильной электронной конфигурации. В результате этого процесса, неметаллы образуют отрицательные ионы, которые имеют большее количество электронов, чем протонов.
Формирование отрицательных ионов у неметаллов происходит потому, что в их внешнем энергетическом уровне располагается так называемая валентная оболочка, которая может вместить определенное количество электронов. При взаимодействии с другими элементами, неметаллы стремятся заполнить свою валентную оболочку и приобретают дополнительные электроны.
Список представленных элементов с их электронной конфигурации подтверждает данный факт:
- Кислород (O): 1s2 2s2 2p4 - формирует ион O^2-, получая 2 дополнительных электрона на своем внешнем уровне;
- Фтор (F): 1s2 2s2 2p5 - формирует ион F^-, получая 1 дополнительный электрон;
- Хлор (Cl): 1s2 2s2 2p6 3s2 3p5 - формирует ион Cl^-, получая 1 дополнительный электрон.
Таким образом, неметаллы способны образовывать отрицательные ионы, что определяет их уникальные свойства и химические реакции.
Металлы образуют катионы

Одной из особенностей химических свойств металлов является их способность образовывать катионы. Катион - это положительно заряженный ион, который образуется при потере одного или нескольких электронов атомом металла.
Металлы характеризуются малым количеством электронов на последнем энергетическом уровне. Обычно это от одного до трех электронов. При взаимодействии с другими атомами, металлы стремятся потерять эти электроны и образовать положительно заряженные ионы.
Например, атом натрия имеет один электрон на последнем энергетическом уровне. При реакции с атомом хлора, натрий отдает свой электрон, образуя положительно заряженный ион Na+. В то же время, атом хлора получает этот электрон и образует отрицательно заряженный ион Cl-.
Еще одним примером является атом железа. У него на последнем энергетическом уровне имеются два электрона. Железо может потерять эти два электрона и образовать Fe2+ или Fe3+ ионы.
В результате образования катионов, металлы приобретают свойство реагировать с анионами и образовывать ионные соединения. Это позволяет им образовывать кристаллические решетки, иметь высокую электропроводность и множество других характеристик, присущих металлам.
Неметаллы образуют анионы
Неметаллы – это элементы, которые преимущественно образуют анионы, то есть отрицательно заряженные ионы, при реакции с металлами.
Все неметаллы, за исключением нескольких радиоактивных элементов, расположены в правой части периодической таблицы. Важными представителями неметаллов являются кислород, азот, хлор, фтор и бром.
Электроотрицательность неметаллов значительно выше, чем у металлов, поэтому они обладают большим аффинитетом к электронам и стремятся получить электроны от других элементов, чтобы достичь стабильной электронной конфигурации. Это приводит к образованию анионов – отрицательно заряженных ионов – у неметаллов.
Анионы неметаллов обычно имеют отрицательный заряд, так как они получают электроны от металлов, которые становятся катионами – положительно заряженными ионами. Образование анионов позволяет неметаллам достичь более стабильной электронной конфигурации, а также увеличить количество электронов на внешнем энергетическом уровне.
Различия в элементных свойствах металлов и неметаллов

Металлы и неметаллы – это две основные группы элементов в периодической таблице, каждая из которых обладает своими уникальными характеристиками.
Электронная структура: Одним из главных различий между металлами и неметаллами является число электронов на последнем энергетическом уровне. У металлов на последнем уровне находится от одного до трех электронов, что делает их склонными к потере электронов и образованию положительных ионов. В то время как у неметаллов на последнем уровне находится от пяти до восьми электронов, и они имеют тенденцию к получению электронов и образованию отрицательных ионов.
Физические свойства: Металлы обладают высокой тепло- и электропроводностью, а также отличаются относительно низкой электроотрицательностью. Они обычно имеют металлический блеск и способны тонко раскатываться в проволоку или расплавляться. Неметаллы, напротив, обычно являются плохими тепло- и электропроводниками, а их электроотрицательность велика. Они могут быть прозрачными или непрозрачными, иметь различные цвета и быть хрупкими.
Химические свойства: Металлы активно взаимодействуют с кислородом, образуя оксиды, которые способны обладать щелочными свойствами. Они также способны реагировать с кислотами и основаниями. Неметаллы, наоборот, образуют оксиды, которые способны обладать кислотными свойствами. Они имеют тенденцию образовывать кислоты при реакции с водой или растворами кислот.
Примеры металлов и неметаллов: Некоторыми примерами металлов являются железо, медь, алюминий, свинец и золото. А неметаллами являются кислород, сера, фосфор, хлор и фтор.
Важно отметить, что существуют также полуметаллы или полупроводники, которые находятся между металлами и неметаллами и обладают как металлическими, так и неметаллическими свойствами.
Вопрос-ответ

Что такое последний уровень электронной оболочки?
Последний уровень электронной оболочки - это самый высокоэнергетический уровень, на котором находятся электроны в атоме. Он определяет валентность атома и его химические свойства.
В чем различия в числе электронов на последнем уровне между металлами и неметаллами?
У металлов число электронов на последнем уровне обычно небольшое и составляет 1-3 электрона. У неметаллов же число электронов на последнем уровне значительно выше и может быть от 4 до 8 электронов.
