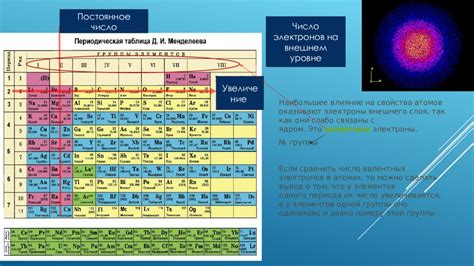
Атомы металлов являются основными строительными блоками материи и обладают своими характерными свойствами. Одно из таких свойств - это число электронов на последнем энергетическом уровне. Это число определяет химические и физические свойства металлов и их способность образовывать ионные и ковалентные связи.
Число электронов на последнем уровне атома металла зависит от его места в периодической системе элементов. Последний энергетический уровень атома металла может быть полностью заполнен (например, у инертных газов), что делает его стабильным и малоактивным химически. Напротив, у металлов последний энергетический уровень не полностью заполнен, что позволяет им образовывать легко смещаемые электроны и проявлять металлические свойства: хорошую проводимость электричества и тепла, гибкость и прочность.
Число электронов на последнем уровне атома металла может варьироваться в зависимости от его позиции в периодической системе элементов. Например, у щелочных металлов (натрий, калий) на последнем энергетическом уровне находится 1 электрон. У щелочноземельных металлов (магний, кальций) на последнем энергетическом уровне находятся 2 электрона. У переходных металлов (цинк, железо) на последнем энергетическом уровне находятся от 1 до 3 электронов. Таким образом, число электронов на последнем уровне атома металла может быть различным и определяет его химические свойства и возможность образования химических связей с другими элементами.
Стабильные конфигурации электронных оболочек

Стабильные конфигурации электронных оболочек в атомах металлов определяются числом электронов на последнем энергетическом уровне. Для большинства металлов это число может быть равно 1, 2 или 3.
Самая распространенная конфигурация металлических атомов - наличие одного, двух или трех внешних электронов на последнем энергетическом уровне. Это облегчает образование и устойчивость химических связей между атомами металла.
Например, литий (Li) имеет конфигурацию 2s1, что означает наличие одного электрона на последнем энергетическом уровне. Атомы кальция (Ca) имеют конфигурацию 4s2, что означает два электрона на последнем энергетическом уровне. В свою очередь, атомы алюминия (Al) имеют конфигурацию 2s2 2p1, что означает три электрона на последнем энергетическом уровне.
Такие стабильные конфигурации обуславливают особые свойства металлов, такие как положительный заряд и способность образовывать ионные и металлические связи. Благодаря этим свойствам, металлы широко используются в различных отраслях промышленности и научных исследований.
Особенности распределения электронов на последнем уровне

Число электронов на последнем уровне атома металла может быть разным и зависит от его положения в периодической системе элементов. Это число определяет особенности химических свойств металлов и их взаимодействие с другими элементами.
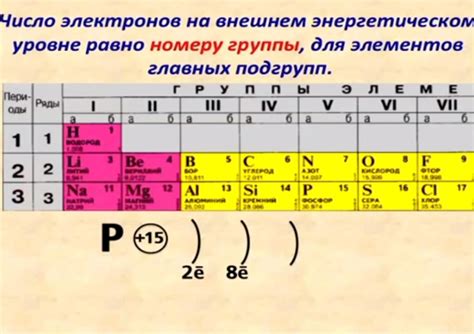
Периодическая система разделена на блоки - s, p, d и f блоки, и каждый блок соответствует определенному уровню энергии электронов в атоме. На последнем уровне металлов, как правило, находится один или два электрона.
Например, у металлов из s-блока, таких как натрий и калий, на последнем уровне находится один электрон. Это делает эти металлы активными элементами, способными легко отдавать свой последний электрон и образовывать положительные ионы.
У металлов из p-блока, например, алюминия и железа, на последнем уровне обычно находятся от одного до шести электронов. Это позволяет им образовывать положительные ионы с разной степенью окисления и обладать разнообразными химическими свойствами.
Металлы из d- и f-блоков имеют на последнем уровне различное количество электронов и обладают сложными электронными конфигурациями. Это влияет на их способность к образованию соединений и магнитные свойства.
Таким образом, число электронов на последнем уровне атома металла играет важную роль в определении его химических свойств и реакционной способности, делая металлы разнообразными и полезными в различных областях науки и технологии.
Влияние внешних условий на число электронов
Атом металла – это составная часть металлического кристалла, в которой находятся свободно движущиеся электроны. Число электронов на последнем энергетическом уровне в атоме металла может быть разным и зависит от внешних условий.
Температура окружающей среды является одним из факторов, влияющих на число электронов на последнем энергетическом уровне. При повышении температуры, электронов на последнем уровне становится больше, так как энергия в системе возрастает. Это обусловлено возрастанием числа возможных энергетических состояний, в которых могут находиться электроны.
Другим фактором, влияющим на число электронов на последнем уровне, является внешнее электрическое поле. Под действием поля электроны могут двигаться в определенном направлении, создавая электрический ток. При увеличении поля, электронов на последнем уровне может становиться больше, так как электрическое поле осуществляет притяжение и увеличивает энергию системы.
Влияние давления на число электронов на последнем уровне атома металла также нельзя не упомянуть. Увеличение давления приводит к сжатию кристаллической решетки и увеличению плотности атомов металла. Это создает дополнительное взаимодействие между атомами, что может привести к изменению числа электронов на последнем энергетическом уровне.
Все эти факторы могут влиять на число электронов на последнем энергетическом уровне атома металла и, следовательно, на его химические свойства. Изменение числа электронов может, в свою очередь, влиять на связь между атомами и наличие свободно движущихся электронов в металлическом кристалле.
Ионное состояние металлов и электроны на последнем уровне

Ионное состояние металлов определяется числом электронов на последнем энергетическом уровне атома данного металла. Электронная конфигурация металлов, как правило, имеет форму ns^2np^6, где n - главное квантовое число, а s и p обозначают энергетические подуровни.
В ионном состоянии металлы стремятся избавиться от лишних электронов или заполнить нехватку, чтобы достичь наиболее стабильной электронной конфигурации. Например, металлы из группы 1 (алкалии) имеют один электрон на последнем уровне и легко его отдают, образуя положительный ион. Металлы из группы 2 (алкоземельные) имеют два электрона на последнем уровне и также склонны образовывать положительные ионы.
Однако, существуют исключения. Некоторые металлы из переходных металлов имеют сложную электронную конфигурацию, и число электронов на последнем уровне может быть разным в различных ионных состояниях. Например, железо (Fe) может находиться в двух ионных состояниях: Fe^2+ и Fe^3+. В ионе Fe^2+ на последнем уровне находятся шесть электронов, а в ионе Fe^3+ - пять электронов.
В целом, электроны на последнем уровне металлов играют ключевую роль в формировании их ионных состояний. Знание электронной конфигурации металлов помогает понять и предсказать их химические свойства и реактивность, а также использовать данные свойства в различных областях науки и техники.
Роль электронов на последнем уровне в химических реакциях

Электроны на последнем уровне атома металла играют важную роль в различных химических реакциях. Их количество определяет химические свойства и способность атома металла образовывать соединения.
Последний энергетический уровень атома металла называется валентным, на нем находятся внешние электроны. Количество электронов на валентном уровне определяет важные свойства металла, такие как химическая активность и способность образовывать соединения с другими элементами.
Электроны на последнем уровне металла могут участвовать в обменных реакциях, образуя связи с электронами других атомов. Такие связи могут быть ковалентными или ионными в зависимости от разности электроотрицательности металла и другого элемента.
Количество электронов на последнем уровне также определяет степень окисления атома металла в химических соединениях. Окислительная способность и способность атома металла к электронному переносу зависят от числа электронов на последнем уровне.
Изменение количества электронов на последнем уровне атома металла может привести к изменению его химических свойств. Например, добавление или удаление электрона может изменить способность атома металла к образованию ионов с различными степенями окисления.
В целом, электроны на последнем уровне атома металла являются ключевыми игроками в химических реакциях, определяя его реакционную способность и формирование химических связей с другими веществами. Понимание и контроль этих электронов позволяет взаимодействовать с металлами и использовать их в различных промышленных процессах.
Примеры металлов с различным числом электронов на последнем уровне
Литий (Li) - металл, у которого на последнем энергетическом уровне находится один электрон. Символ элемента Li обозначает его химическое сокращение и может быть найден в таблице периодических элементов. Литий относится к щелочным металлам и является легким и реактивным элементом.
Кальций (Ca) - металл, имеющий два электрона на последнем энергетическом уровне. Кальций является очень распространенным элементом в земной коре и играет важную роль во многих биологических процессах, включая сокращение мышц и образование костей.
Алюминий (Al) - металл, на последнем энергетическом уровне которого находятся три электрона. Алюминий имеет низкую плотность и хорошую проводимость тепла и электричества, поэтому его широко используют в промышленности для производства различных изделий.
Железо (Fe) - металл, у которого на последнем энергетическом уровне находятся четыре электрона. Это один из наиболее распространенных элементов на Земле и широко используется в промышленности, включая производство стали и металлургию.
Олово (Sn) - металл с различным числом электронов на последнем энергетическом уровне. У олова может быть два, четыре или десять электронов на последнем уровне, в зависимости от его окислительного состояния. Олово широко используется в производстве различных материалов, а также в пайке и литье.
Помимо перечисленных, существует множество других металлов с различным числом электронов на последнем уровне. Количество электронов на последнем уровне влияет на химические свойства металла и его способность вступать в реакции с другими элементами.
Вопрос-ответ

Какое максимальное число электронов может находиться на последнем энергетическом уровне атома металла?
Максимальное число электронов на последнем энергетическом уровне атома металла может быть равно 8.
Почему число электронов на последнем энергетическом уровне атома металла ограничено?
Наличие ограничения числа электронов на последнем энергетическом уровне атома металла связано с конфигурацией электронных оболочек и правилами заполнения энергетических уровней. По правилу октета, на последнем уровне атома металла может находиться не более 8 электронов, чтобы достичь стабильной электронной конфигурации.
Какие металлы имеют максимальное число электронов на последнем уровне?
Металлы в десятой группе (последняя группа) периодической системы элементов - металлы лантаноидов и актиноидов - могут иметь максимальное число электронов на последнем уровне, равное 8.
Как влияет максимальное число электронов на последнем уровне на свойства металлов?
Максимальное число электронов на последнем уровне атома металла влияет на его свойства. Например, элементы соответствующей группы в позиции 10 (последняя группа) периодической системы элементов (лантаноиды и актиноиды) имеют сходные химические свойства, так как они имеют одинаковое число электронов на последнем энергетическом уровне.
