Фосфор – химический элемент массой 31. Находит широкое применение в различных областях науки и промышленности благодаря своим уникальным свойствам. Поэтому необходимо разобраться в его характеристиках, чтобы определить, является ли фосфор металлом или неметаллом. Одним из важных критериев является количество электронов на внешнем слое атома фосфора.
Атом фосфора имеет электронную конфигурацию 1s2 2s2 2p6 3s2 3p3. Это значит, что фосфор имеет 5 электронов на внешнем энергетическом уровне, валентный уровень. По правилу восьми электронов, которое гласит, что атом стремится заполнить свою внешнюю оболочку 8 электронами, фосфор должен образовывать тривалентные соединения.
Таким образом, фосфор является неметаллом, так как он имеет несколько характерных свойств неметаллов. Например, он образует соединения с металлами, обладает высокой электроотрицательностью, формирует ковалентные связи. Также фосфоровые соединения обладают полупроводниковыми свойствами, что актуально в современной электронике.
Фосфор – элемент периодической таблицы

Фосфор – химический элемент с атомным номером 15 и обозначением Р. Он относится к группе пятерки (G15) в периодической таблице, что делает его полуметаллом. Фосфор является очень важным элементом для жизни, поскольку он входит в состав ДНК, РНК и АТФ, основных молекул, отвечающих за хранение и передачу генетической информации, а также за энергетические процессы в организме.
Атом фосфора имеет электронную конфигурацию 1s2 2s2 2p6 3s2 3p3. Это означает, что на его внешнем энергетическом уровне находятся 5 электронов. Это количество электронов делает фосфор активным химическим элементом, способным образовывать множество соединений и реагировать с другими элементами.
Фосфор имеет несколько аллотропных форм, или разновидностей, включая белый фосфор, красный фосфор и черный фосфор. Белый фосфор – самая известная и стабильная форма, но он очень реактивен и может загораться на воздухе. Красный фосфор – более стабильная форма, которая не загорается на воздухе. Черный фосфор является самой стабильной формой и обладает полуметаллическими свойствами.
Фосфор широко используется в различных отраслях, включая производство удобрений, предметов быта, таких как фосфорные спички, и в фармацевтической промышленности. Он также используется в электронике и полупроводниковой промышленности. Благодаря своей реактивности и способности образовывать соединения, фосфор играет важную роль в химической промышленности и науке.
Фосфор в периодической системе

Фосфор (P) - химический элемент с атомным номером 15 и атомной массой около 31. Фосфор принадлежит к группе азота (15) в периодической системе элементов.
В периодической системе фосфор находится между кремнием (Si) и серой (S). Он является неметаллом и образует неорганические соединения с различными элементами.
У атома фосфора на внешнем энергетическом уровне находятся 5 электронов. В связанном состоянии, фосфор образует ионы со значением заряда -3, обретая стабильность.
Фосфор имеет несколько изотопов, и наиболее распространенные из них - фосфор-31 и фосфор-32. Фосфор-31 обладает стабильной ядерной структурой и встречается в природе в большем количестве, в то время как фосфор-32 является радиоактивным и используется в научных и медицинских исследованиях.
Фосфор широко применяется в различных отраслях промышленности, таких как производство удобрений, пластмасс, стекла и других химических продуктов. Он также является важным компонентом для живых организмов, играя ключевую роль в клеточном обмене веществ и связи энергии в форме АТФ.
Химические свойства фосфора

Фосфор - химический элемент симболом P и атомным номером 15. Он расположен в пятой группе периодической системы элементов и принадлежит к элементам группы азота. Фосфор является неметаллическим элементом и может образовывать соединения с различными элементами.
Фосфор обладает высокой реактивностью и способностью образовывать множество соединений. Особенно ярко проявляется его реакционная способность с кислородом. При нагревании фосфор горит с ярким пламенем, образуя оксид фосфора (III) - фосфорную кислоту. Он также может образовывать более высокие оксиды - фосфорникие и гипофосфорные кислоты.
Фосфор способен образовывать множество неорганических и органических соединений, таких как соли фосфорной кислоты, амиды, фосфиты и фосфаты. Фосфаты являются основными компонентами костной ткани, ДНК и АТФ, что подчеркивает важность фосфора для жизни.
Фосфор также может выступать в качестве катализатора в различных химических реакциях и использоваться в производстве удобрений, пищевой и лекарственной промышленности, электроники и других сферах науки и техники.
Применения фосфора
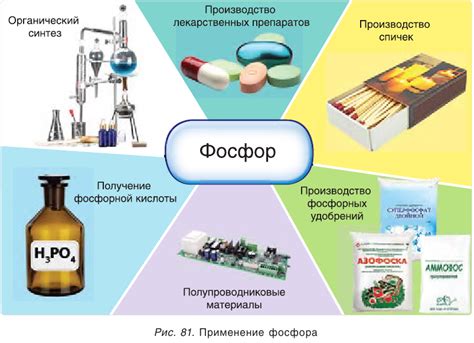
Фосфор - очень важный химический элемент, который находит широкое применение во многих областях науки и промышленности.
В производстве удобрений: Фосфор является необходимым элементом для роста растений. Он используется для производства фосфорных удобрений, которые повышают плодородие почвы и способствуют увеличению урожая. Также фосфор применяется в жидких удобрениях и в качестве питательной добавки для растений.
В производстве стекла и керамики: Фосфор используется в процессе производства стекла и керамики. Он делает стекло прозрачным и устойчивым к воздействию высоких температур. Кроме того, фосфор добавляется в керамику, чтобы улучшить ее механические свойства.
В производстве огнетушителей: Фосфорные соединения используются в производстве огнетушителей. Фосфор, находясь в контакте с кислородом, испускает густой белый дым, который подавляет горение и помогает потушить пожар.
В производстве фармацевтических препаратов: Фосфор является важным компонентом многих фармацевтических препаратов. Он используется в процессе синтеза лекарственных соединений и включается в состав препаратов, используемых для лечения различных заболеваний.
В производстве электроники: Фосфор используется в производстве электронных компонентов, таких как транзисторы и фосфорные светодиоды (LED). Фосфорные светодиоды используются для создания яркого и энергоэффективного освещения, а также в телевизорах и мониторах для передачи цвета.
Таким образом, фосфор имеет множество применений в различных областях, от сельского хозяйства и производства до медицины и электроники. Его свойства делают его незаменимым элементом для многих отраслей промышленности и науки.
Вопрос-ответ

Какое количество электронов на внешнем слое имеет фосфор?
Фосфор имеет 5 электронов на внешнем энергетическом уровне.
Является ли фосфор металлом или неметаллом?
Фосфор является неметаллом.
