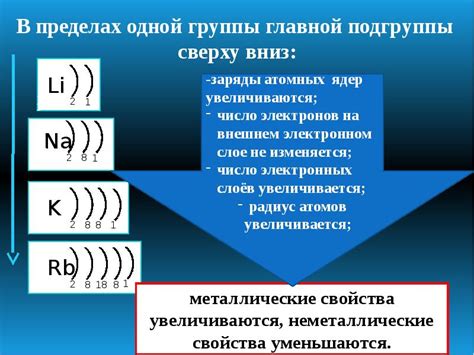
Фосфор (P) является химическим элементом, принадлежащим ко второй группе периодической системы. Он имеет атомный номер 15 и расположен в пятий период. Вопрос о числе электронов на последнем слое у фосфора возникает в связи с его позицией в таблице Менделеева.
Для металлов, таких как натрий или алюминий, число электронов на последнем слое составляет один или два. Этот факт позволяет им образовывать катионы, т.е. положительно заряженные ионы, при потере электронов. Однако фосфор является неметаллом и имеет пять электронов на последнем слое для достижения основного энергетического состояния.
Число электронов на последнем слое у фосфора, равное пяти, указывает на его неметаллические свойства, так как атомы неметаллов стремятся к заполнению своего последнего энергетического слоя до восьми электронов (правило октета). Этот факт определяет химические свойства фосфора, его реактивность и возможность образования химических связей с другими элементами.
Роль электронов в химии фосфора

Фосфор - химический элемент с атомным номером 15 и символом P, расположенный в пяти группе главной подгруппы периодической системы элементов. Он имеет атомную массу 30,974 г/моль и относится к неметаллам. Фосфор обладает особым значением в химии благодаря способности образовывать разнообразные соединения и принимать разные окислительные состояния.
Электроны играют важную роль в химических свойствах фосфора. Фосфор имеет электронную конфигурацию [Ne] 3s2 3p3, что означает, что на последнем энергетическом уровне находятся 5 электронов. Пять электронов во внешней оболочке фосфора делают его реакционноспособным и обладающим уникальными химическими свойствами.
Фосфор может образовывать соединения с другими элементами, в том числе и с металлами. В своих кислых оксидах, фосфор обладает формальной зарядностью 5-. Он может принимать окислительные состояния от -3 до +5, что позволяет ему образовывать соединения с различными степенями окисления.
Электроны во внешней оболочке фосфора играют также ключевую роль в образовании связей. Фосфор способен образовывать ковалентные связи с другими элементами, обменяв свои электроны с электронами соседних атомов. Это способствует образованию стабильных и крепких химических связей, что делает фосфор важным элементом во многих органических и неорганических соединениях.
Таким образом, электроны на последнем энергетическом уровне играют ключевую роль в химии фосфора, определяя его реакционноспособность, окислительные состояния и способность образовывать связи с другими элементами.
Металл фосфора и его последний электронный слой

Фосфор – элемент химической таблицы с атомным номером 15 и символом P. Он относится к неметаллам и преимущественно существует в аморфной, черной форме или в виде многочисленных сплавов с металлами. Однако, фосфор также может образовывать металл, известный как белый фосфор.
Последний электронный слой металла фосфора имеет конфигурацию электронов 3s2 3p3. Это значит, что на его последнем электронном слое находятся 3 электрона. Конфигурация электронов указывает на то, сколько электронов есть на каждом энергетическом уровне. В случае с фосфором, его последний электронный слой заполнен 2 электронами на нижнем 3s-орбитале и 3 электронами на верхней 3p-орбитале.
Благодаря такому распределению электронов, металл фосфора обладает уникальными химическими и физическими свойствами. Он является не только прекрасным редуцирующим агентом, но и демонстрирует пирофорные свойства при комнатной температуре в аморфной форме. Также важно отметить, что фосфор может образовывать автоматические окислительные единицы, которые охватывают его последний электронный слой и могут создавать опасные вещества, такие как фосген.
В целом, металл фосфора и его последний электронный слой играют важную роль в его химической активности и соединениях с другими элементами. Это позволяет ему проявлять разнообразные свойства и применения в различных индустриальных и химических процессах.
Неметалл фосфора и количество электронов на внешнем уровне
Фосфор - неметалл, атомы которого обладают разнообразными свойствами и функциями в молекулярных и биологических системах. В химической нотации фосфор обозначается символом P и имеет атомный номер 15 в периодической системе элементов.
Неметаллы, в отличие от металлов, имеют склонность к приобретению или отрыву электронов на внешнем энергетическом уровне. Количество электронов на внешнем энергетическом уровне, также называемом валентным уровнем, для каждого элемента определяет его химические свойства и способность к образованию химических связей.
У атома фосфора имеется 15 электронов, и эти электроны располагаются на энергетических уровнях. На внешнем энергетическом уровне фосфора находится 5 электронов. Именно эти 5 электронов образуют валентную оболочку и определяют химические свойства фосфора.
Благодаря наличию пяти валентных электронов на внешнем уровне, фосфор способен образовывать различные типы химических связей, включая ионные, ковалентные, металлические и водородные связи. Этот набор химических связей позволяет фосфору участвовать в различных реакциях и образовывать соединения с различными элементами.
Так, фосфор может образовывать металлоидные соединения с металлами, например, фосфиды металлов, а также кислоты и оксиды с неметаллами. Комбинируя свои валентные электроны с электронами других элементов, фосфор способен образовывать различные химические соединения, способные выполнять особые функции в органических и неорганических системах.
Значение полностью заполненного последнего слоя фосфора
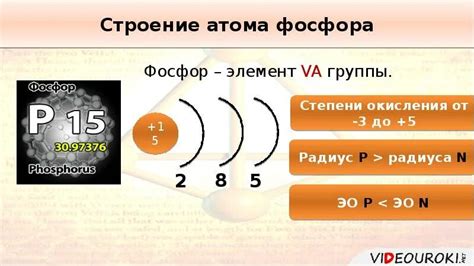
Фосфор - это химический элемент, который имеет электронную конфигурацию в последнем слое 2s22p6. Это означает, что его последний слой полностью заполнен 8 электронами.
Имея 15 электронов в общей электронной конфигурации, фосфор находится в третьем периоде периодической таблицы, что позволяет ему иметь три слоя электронов.
Полностью заполненный последний слой фосфора делает его элементом металла или неметалла. В данном случае, фосфор является неметаллом.
Заполненный последний слой влияет на его свойства и способность образовывать соединения. 8 электронов в последнем слое обеспечивают стабильность для фосфора и могут быть связаны с другими элементами, образуя различные химические соединения.
Свойства фосфора в зависимости от числа электронов на последнем слое
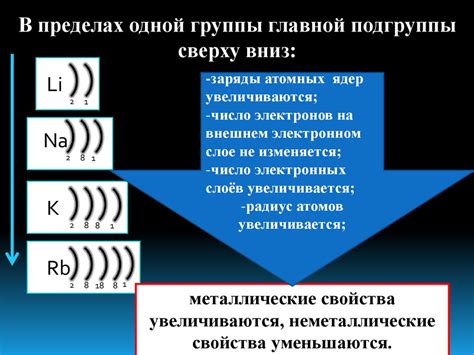
Число электронов на последнем слое является определяющим фактором для определения свойств элементов, в том числе и для фосфора. Фосфор, как неметалл, имеет число электронов на последнем слое, равное 5.
Из-за этого химические свойства фосфора в значительной мере определяются его способностью образовывать соединения с другими элементами. Фосфор образует разнообразные соли, оксиды и кислотные соединения.
Низкие температурах фосфор является твердым веществом, обладающим хрупкостью и непрозрачностью. При нагревании до 44.1 °C фосфор превращается в белое красивое вещество, которое обладает необычными физическими свойствами.
Красное фосфор — этот аллотроп фосфора химически более устойчивый и менее ядовитый, по сравнению с белым фосфором. Красный фосфор используют для изготовления клейковины при изготовлении восковых и полимерных материалов.
Белый фосфор высоко реакционен и подвержен самозажиганию на воздухе, поэтому требует особых условий для хранения. Он используется в производстве огненных смесей и применяется военной промышленности.
Таким образом, число электронов на последнем слое фосфора имеет существенное влияние на его свойства и применение в различных областях.
Вопрос-ответ

Какое число электронов на последнем слое у металлов и неметаллов?
Число электронов на последнем слое у металлов и неметаллов может различаться. У металлов на последнем слое находятся от 1 до 3 электронов, а у неметаллов - от 4 до 8 электронов.
Сколько электронов на последнем слое у фосфора?
У фосфора на последнем слое находятся 5 электронов.
Какие свойства металлов и неметаллов обусловлены числом электронов на последнем слое?
Число электронов на последнем слое влияет на свойства металлов и неметаллов. На основе этого числа могут быть определены такие свойства, как химическая активность, способность образовывать соединения и электронную конфигурацию атома.
Можно ли предсказать химическую активность металла и неметалла, зная число электронов на последнем слое?
Да, по числу электронов на последнем слое можно предсказать химическую активность металла и неметалла. Металлы с малым числом электронов на последнем слое обычно имеют большую химическую активность, тогда как неметаллы с полностью заполненной оболочкой имеют малую активность.
Есть ли металлы с 8 электронами на последнем слое?
Нет, металлы не имеют 8 электронов на последнем слое. У металлов обычно на последнем слое находится меньшее число электронов, от 1 до 3. 8 электронов на последнем слое характерно для инертных газов и неметаллов.
