Металлы - это группа химических элементов, которые обладают высокой проводимостью электрического тока и тепла. Однако, что держит атомы этих элементов вместе, чтобы создавалась такая удивительная сила? Ответ кроется во внутренних силах, которые присутствуют на микроуровне и определяют множество уникальных свойств металлов.
В основе внутренних сил металлов лежит силовое поле, образованное ионами металлов. Силовое поле создается таким образом, что положительно заряженные ионы притягивают отрицательно заряженные электроны, которые вращаются вокруг них. Это приводит к образованию металлической структуры, в которой атомы металлов образуют решетку или сетку, состоящую из положительно заряженных ионов и связанных с ними электронов.
Силы, действующие внутри металла, могут быть описаны силами, действующими на уровне атомов и молекул. Привлекательные силы действуют между положительно заряженными ядрами и отрицательно заряженными электронами, образуя так называемые ионно-электронные связи. Кроме того, электроны в металле также взаимодействуют друг с другом через электростатические притяжения и отталкивания, создавая так называемую электрон связь. Все эти силы действуют одновременно и сбалансированно, обеспечивая прочность и устойчивость металлической структуры.
Кроме того, электроны в металлах могут двигаться свободно по всей структуре, создавая электронное облако, которое называется "море электронов". Это облегчает передвижение электрического тока и делает металлы хорошими проводниками. Взаимодействие этих свободных электронов с положительно заряженными ионами обеспечивает устойчивость металлической решетки и создает прочную связь между атомами металла.
Таким образом, внутренние силы, действующие в металлах, обеспечивают прочность, устойчивость и различные свойства этих материалов. Изучение этих сил имеет важное значение для понимания поведения металлов и их применения в различных отраслях промышленности.
Атомы металлов: внутренние силы и их роль
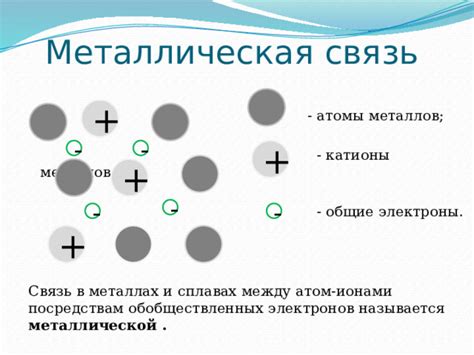
Металлы являются одним из основных классов элементов, обладающих хорошей проводимостью электричества и тепла. Эти уникальные свойства обусловлены особенностями внутренней структуры атомов металлов и взаимодействия между ними.
Основными силами, удерживающими атомы металлов вместе, являются металлическая связь и силы взаимодействия между атомами. Металлическая связь возникает благодаря наличию свободных электронов, которые могут передвигаться между атомами в кристаллической решетке. Эти свободные электроны образуют так называемое "море электронов", которое служит связующим звеном между атомами металлов.
Силы взаимодействия между атомами металлов включают в себя ковалентные и металлические связи. Ковалентная связь проявляется в образовании пар электронов, которые разделяются между двумя атомами. Металлическая связь, как уже было сказано, основана на наличии свободных электронов.
Роль внутренних сил в атомах металлов заключается в обеспечении стабильности кристаллической структуры и свойств металлов. Благодаря металлической связи и силам взаимодействия, атомы металлов могут образовывать компактные решетки и иметь высокую плотность. Это позволяет металлам обладать прочностью, устойчивостью к деформации и способностью проводить электричество и тепло.
Внутренние силы, удерживающие атомы металлов вместе, играют ключевую роль в многих отраслях промышленности и технологий. Металлы используются для создания различных конструкций, проводников, магнитов и других материалов. Понимание этих сил и механизмов взаимодействия атомов металлов является важным для развития новых материалов с улучшенными свойствами.
Влияние электронной структуры
Электронная структура атомов металлов играет важную роль в процессе их взаимодействия и образования кристаллической решетки. Электроны, находящиеся в внешних энергетических уровнях, образуют электронные облака, которые служат своего рода "клеем" для атомов металла.
Внутренние электроны, находящиеся внутри атомной оболочки, создают силы обменного взаимодействия, благодаря которым атомы металла притягиваются друг к другу и образуют кристаллическую решетку. Эти силы связаны с перекрыванием электронных орбиталей между атомами, что обеспечивает стабильность структуры металла.
Также электронная структура определяет термодинамическую устойчивость металла. Атомы металла имеют возможность передавать и принимать электроны, что обеспечивает равновесие между зарядом ядра и числом электронов. Этот обмен электронами приводит к образованию ионного кристалла, который имеет более низкую энергию, чем нейтральные атомы.
Электронная структура также влияет на физические свойства металлов, такие как проводимость электричества и тепла. Наличие свободных электронов в металлической решетке позволяет электронам свободно перемещаться и передавать электрический ток. Также наличие свободных электронов обеспечивает высокую теплопроводность металлов, так как электроны могут быстро передавать тепловую энергию.
Гравитация и масса атомов

Гравитация - это фундаментальная взаимодействие между массами всех объектов во Вселенной. Она является одной из внутренних сил, определяющих взаимодействие атомов в металлах и их удержание вместе.
Масса атома - это характеристика его инертности и определяется суммой масс нейтронов и протонов в ядре атома. Масса атома имеет прямое влияние на гравитационные силы между атомами, потому что чем больше масса атома, тем сильнее притяжение между ними.
В металлах атомы расположены очень близко друг к другу, и гравитационные силы между ними становятся значительными. Это способствует образованию сильной внутренней структуры, которая держит их вместе и придает металлу его прочность и устойчивость.
Влияние межатомных связей
Межатомные связи играют важную роль в удержании атомов металлов вместе, образуя кристаллическую структуру и определяя их физические свойства. Существует несколько типов межатомных связей, каждый из которых обладает своими свойствами и характеристиками.
Одним из самых распространенных типов межатомных связей в металлах является металлическая связь. Она основана на донорно-акцепторном взаимодействии между свободными электронами внешней оболочки атомов металлов. Эти свободные электроны образуют "облако" электронов, которое окружает положительно заряженные ионы металла. Благодаря этой связи металлы обладают хорошей электропроводностью и теплопроводностью.
Другой тип межатомных связей в металлах - ионная связь. Она основана на электростатическом взаимодействии между положительно и отрицательно заряженными ионами. В кристаллической структуре металлов ионы образуют регулярную решетку, где положительно заряженные ионы расположены регулярно в решетке, а отрицательно заряженные ионы окружают их. Ионная связь обеспечивает прочность и твердость металлов.
Ковалентная связь также может играть некоторую роль в межатомных взаимодействиях металлов. Ковалентная связь возникает, когда атомы металла обмениваются парами электронов, образуя ковалентные связи. Это может происходить в специфических случаях, когда атомы имеют низкую электроотрицательность, что способствует образованию ковалентных связей.
Таким образом, межатомные связи оказывают влияние на структуру и свойства металлов. Они определяют их электропроводность, теплопроводность, прочность и твердость, что делает металлы ценными материалами для различных отраслей промышленности и прочих областей человеческой деятельности.
Роль электромагнитных сил
Атомы металлов удерживаются вместе благодаря силе электромагнитного взаимодействия. Эти силы возникают между электрическими зарядами, которыми обладают атомы. Когда атомы металла приближаются друг к другу, их электроны и ядра взаимодействуют между собой.
Внутри атомов находятся электроны, которые движутся по орбитам вокруг ядра. У электрона есть отрицательный электрический заряд, а у ядра - положительный заряд. Это приводит к созданию электрического поля внутри атома.
В металлах электроны находятся в общем, свободном состоянии. Это значит, что электроны не привязаны к конкретным атомам, а могут свободно перемещаться по всей структуре металла. В результате образуется так называемая "электронная оболочка", которая окружает ядра атомов и формирует металлическую сеть.
Именно электронная оболочка играет ключевую роль в удержании атомов металла вместе. Силы электромагнитного взаимодействия между электронами и ядрами атомов, а также между электронами и другими электронами создают прочные связи, которые обеспечивают сопротивление разрушению металлической структуры.
Влияние температуры и давления
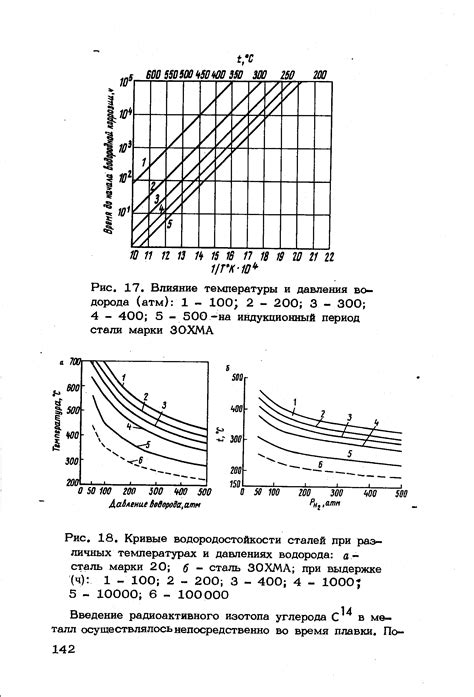
Внутренние силы, удерживающие атомы металлов вместе, зависят от температуры и давления. Изменение этих параметров может значительно влиять на свойства и структуру металлов.
При повышении температуры, атомы металлов начинают вибрировать с большей амплитудой. Это влияет на расстояние между атомами и их порядок в кристаллической решетке. Таким образом, температура может вызывать изменение объема и формы металлов.
Повышение давления приводит к сжатию атомов в металлической решетке, что увеличивает силу взаимодействия между ними. Это может привести к упрочнению металла и улучшению его механических свойств. Однако, при достижении критического значения давления, металл может перейти в другую структурную фазу или даже стать аморфным.
Влияние температуры и давления на металлы имеет важное значение для различных промышленных процессов и исследований в области материалов. Изучение этих внешних факторов позволяет предсказывать и контролировать свойства металлов, что открывает новые возможности для разработки и улучшения материалов и изделий.
Баланс между силами притяжения и отталкивания
Атомы металлов удерживаются вместе благодаря сложному балансу между силами притяжения и отталкивания, которые действуют между ними.
Внутри атома находится ядро, состоящее из протонов и нейтронов, которое обладает положительным зарядом. Вокруг ядра движутся электроны, которые имеют отрицательный заряд.
Силы притяжения действуют между положительно заряженным ядром и отрицательно заряженными электронами. Эти силы удерживают электроны на своих орбитах вокруг ядра и предотвращают их полет в пространстве.
Однако, между электронами также действуют силы отталкивания. По причине того, что электроны имеют одинаковый заряд, они отталкивают друг друга.
Благодаря существованию этих противоречивых сил, удалось достичь устойчивого равновесия внутри атома. Силы притяжения и отталкивания сбалансированы таким образом, что атом не разваливается и не схлопывается.
Именно этот баланс между силами притяжения и отталкивания позволяет металлам обладать свойством устойчивого состояния и образовывать прочные соединения.
Вопрос-ответ

Какие силы удерживают атомы металлов вместе?
Атомы металлов удерживаются вместе благодаря взаимодействию ионных связей и металлических связей.
Что такое ионные связи?
Ионные связи возникают, когда атомы металлов отдают или получают электроны и образуют положительные и отрицательные ионы. Взаимодействие этих ионов создает электростатическую силу, которая удерживает атомы вместе.
Что такое металлические связи?
Металлические связи возникают, когда свободные электроны в металле образуют "облако" вокруг положительных ядер атомов. Эти свободные электроны двигаются между атомами и создают электростатическую силу, которая удерживает атомы металлов вместе.
Почему атомы металлов образуют ионные и металлические связи?
Атомы металлов имеют низкую электроотрицательность, что означает, что они более готовы отдать электроны, чем принять их. Это позволяет атомам образовывать положительные ионы и участвовать в образовании ионных связей. Кроме того, у металлов обычно много свободных электронов, которые легко передаются между атомами и образуют металлические связи.
Какое значение имеют внутренние силы в металлах?
Внутренние силы, такие как ионные и металлические связи, имеют огромное значение в металлах. Они обеспечивают прочность и твердость материала, позволяют металлам иметь высокую теплопроводность и электропроводность, а также создают особые свойства, такие как пластичность и деформируемость.
