Цезий - химический элемент с атомным номером 55 и символом Cs. Он относится к группе щелочных металлов и является одним из самых реактивных элементов в периодической системе элементов. При комнатной температуре цезий имеет серебристый цвет и мягкую структуру, что делает его одним из наиболее низкоплавких металлов.
Цезий обладает рядом уникальных свойств, что делает его интересным объектом исследований. Например, он имеет наибольшую электроотрицательность и единственные две известные стабильные изотопы с нечетным числом нейтронов. Кроме того, цезий обладает высокой теплопроводностью и хорошо растворяется в воде, образуя щелочной раствор.
Однако, несмотря на свою реактивность, цезий не является широко применяемым металлом в промышленности. Его главным применением является использование в исследованиях и технологиях ядерной энергетики, включая включает генераторы омега-рельсотрона, радиоизотопные термоэлектрические генераторы и источники излучения для медицинских и промышленных целей.
Химические элементы: цезий и другие металлы

Цезий – это химический элемент, который относится к группе щелочных металлов. Он является очень реактивным элементом со сверхнизкой электроотрицательностью. Цезий имеет атомный номер 55 и химический символ Cs. Этот металл обладает мягкой текстурой и серебристо-белым цветом.
Цезий обладает рядом интересных свойств. Он является самым реактивным металлом среди всех щелочных элементов. Он очень активно реагирует с водой, выпуская водород и образуя гидроксид цезия. Цезий также способен воспламеняться на воздухе и взрываться при воздействии на него даже небольших количеств воды.
В таблице активности металлов, цезий занимает почетное место, располагаясь на самом низком уровне активности. Это связано с его большим размером атома и слабой связью между атомами металла. Вследствие этого, цезий легко отделяется от своих соединений, образуя ион с положительным зарядом.
Вместе с цезием, в группе щелочных металлов находятся еще несколько элементов: литий, натрий, калий, рубидий и франций. Все они обладают схожими свойствами и способностью активно взаимодействовать с различными веществами. Они используются в различных областях науки и технологии, включая производство батареек, лекарственных препаратов и сплавов для высокотемпературных приложений.
В заключение, химические элементы, такие как цезий и другие металлы, играют важную роль в нашей повседневной жизни и имеют широкий спектр применений. Изучение их свойств и химических реакций позволяет нам лучше понять мир вокруг нас и использовать эти знания для развития науки и технологии.
Активность металлов в периодической таблице
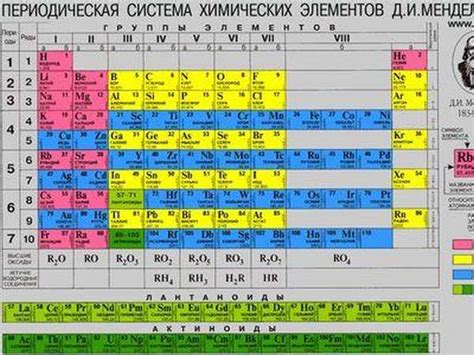
Периодическая таблица элементов включает в себя информацию о различных химических элементах, включая металлы. Металлы в периодической таблице расположены в левой части и занимают большую часть таблицы.
Активность металлов может быть определена по их способности реагировать с другими веществами. Некоторые металлы очень активны и легко реагируют с кислородом, водой и другими реактивами. Например, щелочные металлы, такие как литий, натрий и калий, являются очень активными и реагируют с водой с выделением водорода.
В периодической таблице активность металлов увеличивается по направлению от правого верхнего угла к нижнему левому углу. Это связано с изменением электронной структуры атомов металлов по мере движения вниз и влево по таблице. Наиболее активные металлы находятся в левой верхней части таблицы, такие как литий и калий. Более реакционноспособные металлы расположены ниже и влево от них, например, натрий и кальций.
Активность металлов имеет важное значение в различных областях химии и промышленности. Некоторые металлы используются в производстве батарей, алюминия, стали и других материалов. Также активные металлы могут использоваться в качестве катализаторов для различных химических реакций.
Важно отметить, что активность металлов может меняться в зависимости от условий реакции и окружающей среды. Некоторые металлы могут быть стабильными в одних условиях и активными в других. Это свойство металлов позволяет использовать их в различных приложениях и инженерных решениях.
Выводящий металл в периодической таблице также играет важную роль в активности других металлов. Выводящий металл имеет более низкую активность, поэтому он может заместить более активный металл в химической реакции. Например, цинк может замещать медь в реакции с кислотами.
Физические свойства цезия

Цезий - химический элемент, мягкий и серебристо-белый металл, обладает рядом уникальных физических свойств.
Одним из главных физических свойств цезия является его низкая температура плавления. Цезий плавится уже при температуре около 28 градусов Цельсия, что делает его одним из самых низкоплавких металлов в природе. Благодаря этому свойству, цезий мягко плавится в руке при комнатной температуре и может быть легко моделирован в различные формы.
Другим интересным физическим свойством цезия является его электропроводность. Цезий является одним из самых хороших проводников электричества среди всех металлов. Он обладает очень низким сопротивлением и способен передавать электрический ток с высокой эффективностью. Благодаря этой особенности, цезий широко применяется в электронике и технологии.
Еще одной особенностью цезия является его низкая радиоактивность. Цезий-137, самый известный радиоизотоп этого элемента, обладает относительно долгим периодом полураспада и часто применяется в ядерной технологии и медицине. Однако, при правильном использовании и хранении, цезий не представляет опасности для здоровья человека.
Таким образом, цезий обладает набором интересных и полезных физических свойств, которые делают его уникальным элементом в таблице периодических элементов.
Химические свойства цезия
Цезий (Cs) - мягкий и химически активный металл, который обладает несколькими уникальными химическими свойствами.
Цезий обладает высокой реакционной способностью, особенно при взаимодействии с кислородом. При контакте с воздухом цезий быстро окисляется, образуя оксид цезия (Cs2O), который обладает ярко-желтым цветом.
Цезий проявляет широкую реакционную способность с большинством неметаллов, образуя с ними различные химические соединения. В частности, цезий может образовывать соединения с халогенами (фтором, хлором, бромом, иодом), в результате чего образуются цезиевые соли халогенов.
Цезий способен также вступать в реакцию с серой, образуя цезиевую соль серы. Кроме того, цезий может образовывать сложные соединения с органическими соединениями, такими как аммиак и эфиры.
Цезий обладает высокой реакционной способностью с водой, в результате чего образуется гидроксид цезия (CsOH) - сильное основание, которое обладает щелочными свойствами. Гидроксид цезия широко используется в химической промышленности для производства щелочей и моющих средств.
Вопрос-ответ

Что такое цезий?
Цезий - это химический элемент с символом Cs и атомным номером 55. Это мягкий и сильно реактивный щелочной металл, который легко окисляется на воздухе и реагирует с водой.
Какие свойства у цезия?
Цезий имеет низкую температуру плавления и кипения, и его плотность ниже, чем у большинства других металлов. Он также обладает хорошей электрической проводимостью и высокой реактивностью.
Для чего используется цезий?
Цезий используется в различных отраслях, включая производство электрических компонентов, исследования в области атомной энергетики, производство стекла и даже в медицине.
Какую таблицу активности металлов цезий занимает?
Цезий находится внизу таблицы активности металлов и является одним из самых активных щелочных металлов.
Какими опасными свойствами обладает цезий?
Цезий, особенно его радиоактивный изотоп цезий-137, является опасным веществом из-за его высокой радиоактивности. Он может проникать в организм через пищу и воду, накапливаться в тканях и вызывать раковые заболевания и другие серьезные заболевания.
