В химии 9 класса одной из важных тем является изучение цепочек превращений металлов. Металлы, такие как железо, медь, свинец и цинк, могут подвергаться различным химическим реакциям, в результате которых они превращаются в другие вещества. Знание основных реакций металлов является важным для понимания процессов, происходящих в различных промышленных секторах и в природе.
Одной из основных реакций металлов является окисление. При взаимодействии металлов с кислородом происходит образование металлических оксидов. Например, железо может вступать в реакцию с кислородом из воздуха и образовывать оксид железа (III), который обычно называется ржавчиной. Медь при окислении образует оксид меди (II), который имеет зеленовато-черный цвет.
Другой важной реакцией металлов является образование солей. Металлы могут взаимодействовать с кислотами и образовывать соли. Например, железо может реагировать с соляной кислотой и образовывать хлорид железа (III). Свинец может образовывать нитрат свинца при реакции с азотной кислотой. Это важные процессы, применяемые в производстве различных химических веществ и удобрений.
Также, металлы могут вступать в реакцию с веществами, содержащими серу, и образовывать сульфиды. Например, цинк может образовывать сульфид цинка при реакции с серной кислотой. Медь может образовывать сульфид меди при взаимодействии с сероводородом. Эти реакции широко используются в производстве полупроводников и различных электрохимических устройств.
Основные реакции в химии 9 класс: цепочки превращений металлов

Одним из важных аспектов изучения химии в 9 классе являются цепочки превращений металлов. Эти превращения – это реакции, которые происходят при взаимодействии различных металлов с разными веществами. В результате этих реакций происходят изменения состояния металлов и образуются новые вещества.
Одной из основных реакций в химии 9 класс является реакция металла с кислотой. При этой реакции металл вступает во взаимодействие с кислотой и образуется соль и водород. Например, реакция цинка с серной кислотой приводит к образованию сульфата цинка и выделению водорода:
- Zn + H2SO4 → ZnSO4 + H2
Другой важной цепочкой реакций в химии 9 класс является реакция металла с водой. При этой реакции алкали металлы (как натрий и калий) взаимодействуют с водой, образуется щелочь и выделяется водород. Реакция натрия с водой приводит к образованию гидроксида натрия и выделению водорода:
- 2Na + 2H2O → 2NaOH + H2
Также в химии 9 класс изучают реакции окисления металлов. Окисление – это реакция, при которой металл взаимодействует с кислородом. Например, реакция железа с кислородом приводит к образованию окиси железа:
- 4Fe + 3O2 → 2Fe2O3
Таким образом, изучение основных реакций в химии 9 класс важно для понимания химических превращений металлов и получения новых веществ. Эти реакции позволяют ученикам развить навыки анализа химических процессов и применять их в практических задачах.
Разложение воды на водород и кислород

Разложение воды на водород и кислород — это химическая реакция, при которой молекула воды (H2O) расщепляется на два атома водорода (H2) и один атом кислорода (O2). Она происходит при попадании энергии на молекулу воды и является обратной реакцией к объединению водорода и кислорода водой.
Разложение воды на водород и кислород может происходить под воздействием электрического тока при электролизе. В этом процессе вода разлагается на водород и кислород под воздействием действующего электрического поля. При электролизе вода становится проводником электричества, и на электроды накапливается водород и кислород.
Другой способ разложения воды на водород и кислород - это термическое расщепление. При нагревании воды до высокой температуры (например, 2000 градусов Цельсия) она расщепляется на водород и кислород. Этот процесс используется в промышленности для получения водорода.
Разложение воды на водород и кислород является фундаментальной реакцией, которая играет важную роль в химических и энергетических процессах. Водород, полученный при разложении воды, широко используется в промышленности в качестве сырья для производства аммиака, рафинирования нефти и производства водородных топливных элементов. Кислород же, полученный при этой реакции, необходим для дыхания живых организмов и применяется в медицине и промышленности.
Растворение щелочных металлов в воде

Растворение щелочных металлов в воде – это химические реакции, при которых металлы группы 1 в таблице Менделеева растворяются в воде, образуя щелочные растворы. Такие металлы, как литий (Li), натрий (Na), калий (K) и др., имеют высокую реакционноспособность и могут легко взаимодействовать с водой.
Реакция растворения щелочных металлов в воде протекает следующим образом. При контакте с водой металл образует ион щелочного металла и высвобождает водород. Например, при растворении натрия в воде появляется реакционная способность Na -> Na+ + e-, на электрон гидроксидный ион OH- -> H2O + e- -> 2OH-. Здесь водород и щелочные ионы плавают в жидкой среде и придают раствору щелочные свойства.
Раствор щелочных металлов в воде является щелочным, так как содержит гидроксидные ионы. Это подтверждается изменением цвета индикатора – указателя щелочности. Красный капустный сок, содержащий индикаторы, переходит из красного в зеленый при попадание щелочи в раствор щелочного металла. В то же время, такой раствор проводит электрический ток, что указывает на наличие ионов.
Таким образом, растворение щелочных металлов в воде является важной реакцией, которая позволяет получать щелочные растворы искусственным путем, а также использовать их в различных химических процессах и технологиях.
Окисление металлов кислородом
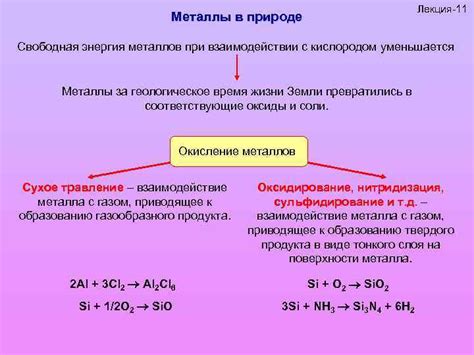
Окисление металлов кислородом – один из основных типов реакций, которые происходят между металлами и кислородом. Кислород может окислить металлы различными способами:
- Сжигание – при сжигании металл образует оксид, который в своей основе представляет собой соединение металла с кислородом.
- Реакция с водой – некоторые металлы способны реагировать с водой, образуя гидроксиды, при этом кислород выделяется в виде пузырьков.
- Реакция с кислородом в воздухе – некоторые металлы могут реагировать с кислородом в воздухе, образуя оксиды, которые в дальнейшем могут дальше превращаться в другие соединения.
Окисление металлов кислородом является важным процессом, который происходит в природной среде, так как многие руды и рудные минералы содержат металлы, которые вступают в реакцию с кислородом. Также окисление металлов кислородом является основой для получения оксидов металлов, которые широко используются в различных отраслях промышленности.
Процессы окисления металлов кислородом важны для понимания химических реакций, происходящих с металлами, и помогают объяснить ряд явлений, таких как коррозия металлов или образование оксидных пленок. Кроме того, изучение этих процессов позволяет разрабатывать способы защиты металлов от окисления и коррозии.
Взаимодействие металлов с кислотами

Взаимодействие металлов с кислотами является одной из фундаментальных реакций в химии. При этом металлы образуют соединения с кислотами, вытесняя из них водород.
Реакция взаимодействия металла с кислотой протекает с образованием соли и выделением водорода. Количество выделяемого водорода зависит от активности металла и концентрации кислоты. Некоторые металлы, такие как натрий и калий, обладают высокой активностью и реагируют с кислотами даже при низкой концентрации. Другие металлы, такие как свинец и медь, реагируют только с сильными кислотами.
Реакция взаимодействия металла с кислотой можно схематично представить следующим образом:
| Металл | Кислота | Соль |
|---|---|---|
| M | H2SO4 | MSO4 |
| M | HCl | MCl |
Взаимодействие металлов с кислотами имеет большое практическое значение. Например, серная кислота (H2SO4) используется при получении металлического сульфата (MSO4), который находит применение в различных отраслях промышленности, таких как производство удобрений и красителей. Клориды металлов, получаемые в результате реакции соляной кислоты (HCl) с металлами, используются, например, в гальванических процессах.
Взаимодействие металлов с гидроксидами
Металлы могут проявлять активность в реакциях с гидроксидами, которые представляют собой соли кислот с водой. В результате таких реакций образуются гидроксиды металлов, которые могут быть как растворимыми, так и нерастворимыми в воде.
Самой распространенной реакцией является гидроксидное осаждение, когда металл вступает в реакцию с водным раствором гидроксида. В результате реакции образуется нерастворимый осадок гидроксида металла. Так, например, реакция алюминия с гидроксидом натрия приводит к образованию нерастворимого осадка гидроксида алюминия.
Реакция взаимодействия металлов с гидроксидами может быть представлена в виде химического уравнения. Например, реакция цинка с гидроксидом натрия будет иметь вид: Zn + 2NaOH → Zn(OH)2 + 2Na.
Однако не все металлы проявляют такую активность при взаимодействии с гидроксидами. Некоторые металлы не реагируют с гидроксидами вообще или реагируют очень медленно. Например, такие металлы, как золото и платина, не реагируют с гидроксидами.
Взаимодействие металлов с гидроксидами является одной из важных реакций в химии. Оно находит применение в различных областях, таких как производство металлов, аналитическая химия и другие.
Реакции нежелезных металлов с солями железа(III)

Реакции нежелезных металлов с солями железа(III) важны в химии и на практике. Такие реакции позволяют получать различные соединения и материалы. В ходе этих реакций, нежелезные металлы выталкивают железо из его солей, образуя новые соединения.
Например, реакция меди с солями железа(III) приводит к образованию зеленой соли меди и осаждению бурых осадков железа. Реакция цинка с солями железа(III) приводит к образованию бесцветных солей цинка и темно-синих осадков железа.
Такие реакции можно использовать, например, для получения различных пигментов, используемых в красках и пластике. Кроме того, такие реакции могут служить основой для получения железистых сплавов, в которых нежелезные металлы вступают в реакцию с железом, улучшая его свойства.
Реакции щелочных металлов с серной кислотой
Реакция щелочных металлов с серной кислотой является одной из важных химических реакций. Щелочные металлы, такие как натрий, калий и литий, реагируют с серной кислотой, образуя соответствующие соли и выделяя водород.
Например, реакция натрия с серной кислотой протекает по следующему уравнению:
2Na + H2SO4 → Na2SO4 + 2H2
В результате этой реакции образуется соль натрия с серной кислотой и выделяется молекулы водорода. При этом раствор кислоты меняет свою окраску, становясь бесцветным.
Аналогично реагируют и другие щелочные металлы, такие как калий и литий. Данная реакция проводится, например, для получения серы при промышленном производстве.
Таким образом, реакция щелочных металлов с серной кислотой является важным процессом, который используется как в лабораторных условиях, так и в промышленности.
Взаимодействие металлов с нитратами
Нитраты — соли азотной кислоты — широко используются в химической промышленности и сельском хозяйстве. Взаимодействие металлов с нитратами происходит, когда металл замещает в реакции ион водорода или другой металл. Такие реакции могут иметь различную интенсивность и протекать с разными скоростями в зависимости от свойств металлов и условий реакции.
Реакция взаимодействия металлов с нитратами может приводить к образованию оксида металла, оксида азота и воды. Например, реакция цинка с нитратом меди(II) приводит к образованию оксида цинка, оксида азота и воды:
- Zn + 2Cu(NO3)2 → 2CuO + Zn(NO3)2
- Zn + 2NO2 + H2O → 2CuO + Zn(NO3)2
Некоторые металлы, как железо и алюминий, не реагируют с нитратами при обычных условиях. Однако, при нагревании они могут разлагать нитраты и образовывать оксиды металла, оксид азота и кислород:
- 6Fe + 10NaNO3 → 6FeO + 5N2O + Na2O + 5O2
- 4Al + 10NaNO3 → 2Al2O3 + 5N2O + 10Na2O
Взаимодействие металлов с нитратами — это одна из многих реакций, демонстрирующих активность металлов и их химическую активность. Эти реакции часто используются в лабораторных исследованиях и промышленности для получения различных соединений на базе металлов.
Вопрос-ответ

Какие металлы могут реагировать с кислотами?
С кислотами могут реагировать различные металлы, такие как цинк, железо, алюминий и др. При этом образуются соли и выделяется водород.
Что такое окисление и восстановление металлов?
Окисление - процесс, при котором металл отдает электроны, а восстановление - процесс, при котором металл получает электроны. В химии металлы могут претерпевать окислительно-восстановительные реакции, в результате которых меняется степень окисления металла.
