Щелочные металлы, такие как литий, натрий, калий, радий и цезий, являются важными элементами в неорганической химии. Они обладают низкой энергией ионизации и способностью образовывать положительные ионы, что делает их очень реактивными и может использоваться во многих химических реакциях и процессах.
Существуют различные способы превращения щелочных металлов в другие соединения и соединения, включающие в себя цепочки превращений. Один из таких способов - реакция с кислородом в воздухе. Щелочные металлы имеют высокую аффинность к кислороду и образуют оксиды, такие как оксид лития, оксид натрия и оксид калия.
Другой способ - реакция щелочных металлов с водой. В этой реакции образуются гидроксиды щелочных металлов, такие как гидроксид лития, гидроксид натрия и гидроксид калия. Эти гидроксиды имеют широкое применение, как например, в производстве щелочных батарей, щелочных металлов широко используются в производстве стекла, мыла, моющих средств, а также используются в фармацевтической промышленности.
Цепочки превращений щелочных металлов в неорганической химии являются важными для понимания физико-химических свойств и поведения щелочных металлов. Эти превращения помогают исследователям понять причины реакций щелочных металлов с другими веществами и улучшить применение этих металлов в различных отраслях промышленности и науки.
Основные принципы цепочек превращений щелочных металлов

Цепочки превращений щелочных металлов представляют собой последовательность химических реакций, в которых щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, превращаются в различные неорганические соединения.
Основным принципом цепочек превращений щелочных металлов является их реактивность и способность образовывать стабильные соединения с различными элементами. Например, щелочные металлы реагируют с кислородом, образуя оксиды, с серой - сульфиды, с азотом - нитриды и так далее. Эти реакции основаны на электрохимических свойствах щелочных металлов, таких как низкая электроотрицательность и высокая реакционная способность.
Цепочки превращений щелочных металлов могут быть использованы в различных областях неорганической химии. Например, они могут быть применены в процессах синтеза неорганических соединений, в качестве катализаторов химических реакций или в процессах очистки воды. Благодаря своей реактивности и способности образовывать разнообразные соединения, щелочные металлы представляют большой интерес для исследований и разработок в области неорганической химии.
Реакции в неорганической химии с участием щелочных металлов

Щелочные металлы (натрий, калий, рубидий, цезий, литий) являются активными элементами, которые обладают способностью образовывать разнообразные соединения с другими веществами. Реакции с участием щелочных металлов широко используются в неорганической химии для получения новых веществ и проведения различных синтезов.
Одной из ключевых реакций щелочных металлов является их реакция с водой. При контакте с водой щелочные металлы образуют гидроксиды соответствующих металлов и выделяются газы. Например, натрий взаимодействует с водой, образуя гидроксид натрия (NaOH) и выделяя водород (H2). Эта реакция является экзотермической, то есть сопровождается выделением тепла.
Щелочные металлы также реагируют с кислотами, образуя соли и выделяя водород. Например, реакция натрия с серной кислотой дает сульфат натрия и выделяет водород. Подобные реакции широко применяются при получении солей щелочных металлов и в других процессах синтеза.
Еще одним важным типом реакций щелочных металлов является их взаимодействие с галогенами (хлором, бромом, йодом). При этом образуются галогениды металлов. Например, натрий реагирует с хлором, образуя хлорид натрия. Эти реакции часто применяются для получения галогенидов щелочных металлов в лабораторных условиях.
Реакции в неорганической химии с участием щелочных металлов имеют важное практическое применение в различных отраслях науки и техники. Они используются при получении различных соединений щелочных металлов, создании новых материалов, производстве лекарственных препаратов и других веществ.
Взаимодействие щелочных металлов с другими элементами

Щелочные металлы, такие как литий, натрий и калий, проявляют высокую активность при взаимодействии с другими элементами. Они легко реагируют с кислородом, хлором, бромом и другими галогенами, образуя соответствующие оксиды и галогениды. Например, литий при контакте с воздухом сгорает, образуя оксид лития (Li2O) или пероксид лития (Li2O2), а натрий образует оксид натрия (Na2O) или пероксид натрия (Na2O2).
Щелочные металлы также взаимодействуют с водой, образуя щелочные растворы. Например, литий и натрий реагируют с водой, выделяя водород и образуя гидрооксиды лития (LiOH) и натрия (NaOH). Эти гидрооксиды являются сильными основаниями и широко используются в химической промышленности.
Кроме того, щелочные металлы могут образовывать соли с различными кислотами. Например, литий реагирует с серной кислотой, образуя сульфат лития (Li2SO4), а натрий реагирует с уксусной кислотой, образуя ацетат натрия (CH3COONa).
Взаимодействие щелочных металлов с другими элементами имеет большое значение для различных отраслей науки и техники. Например, щелочные металлы используются в батареях, каталитических процессах, производстве стекла и сплавов. Они также широко применяются в фармацевтической и пищевой промышленности. Взаимодействие щелочных металлов с другими элементами позволяет получать новые вещества с уникальными свойствами и применениями.
Основные этапы цепочек превращений щелочных металлов
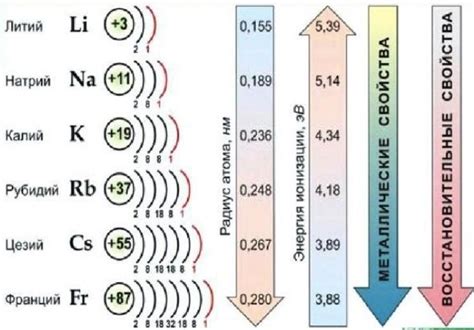
Цепочки превращений щелочных металлов представляют собой последовательность реакций, при которых исходные щелочные металлы претерпевают различные превращения, приводящие к образованию новых соединений. Они широко применяются в неорганической химии и имеют значительный научный и практический интерес.
Основным этапом цепочек превращений является активация ионов щелочных металлов, которая может происходить при помощи различных реагентов. Например, для активации иона натрия можно использовать амины или карбоцефир. Такая активация позволяет эффективно превращать ионы щелочных металлов в соединения, необходимые для дальнейшей реакции.
Дальнейшим этапом цепочек превращений является образование комплексов с щелочными металлами. Эти комплексы играют важную роль во многих химических процессах и могут образовываться с различными лигандами. Например, образование комплексов с аммиаком или этилендиамином позволяет получить стабильные соединения щелочных металлов.
Следующим этапом цепочек превращений является получение соединений щелочных металлов с различными анионами. Это можно сделать путем обмещения лигандов в комплексных соединениях либо замещения анионов в уже существующих соединениях. Например, замещение иона хлора на нитратные или сульфатные ионы позволяет получить новые соединения с измененными свойствами и возможностями применения.
Конечным этапом цепочек превращений щелочных металлов является получение стабильных и химически инертных соединений. Например, образование соединений с карбонатным или гидроксидным ионами позволяет получить высокостабильные и твердые вещества, которые могут использоваться в различных отраслях промышленности.
Применение цепочек превращений щелочных металлов в различных сферах

Цепочки превращений щелочных металлов - это важный инструмент в неорганической химии и находят широкое применение в различных сферах. Они играют ключевую роль в создании катализаторов, материалов для электродов, легирования различных сплавов и других промышленных процессах.
В области катализа цепочки превращений щелочных металлов используются для создания эффективных катализаторов, которые могут способствовать различным химическим реакциям. Например, катализаторы на основе щелочных металлов могут применяться в процессах водородации, гидрирования, окисления и других важных химических превращениях. Они позволяют увеличить скорость реакции и повысить ее эффективность.
В электрохимии цепочки превращений щелочных металлов играют важную роль в создании электродов с высокой производительностью и стабильностью. Такие электроды на основе щелочных металлов могут быть использованы в различных приложениях, включая электролиз, аккумуляторы, топливные элементы и другие энергетические системы.
Цепочки превращений щелочных металлов также применяются в процессе легирования различных сплавов. Легированные металлы обладают улучшенными физическими и химическими свойствами, что делает их более прочными, стойкими к коррозии и устойчивыми к высоким температурам. Применение цепочек превращений щелочных металлов позволяет создавать сплавы с оптимальными свойствами для различных индустриальных и научных целей.
Вопрос-ответ

Какие основные принципы перескока щелочных металлов в неорганической химии?
Перескок щелочных металлов в неорганической химии основан на принципе образования стабильных соединений с отрицательными зарядами. Щелочные металлы, такие как литий, натрий, калий и др., имеют один внешний электрон, который легко отдают, образуя положительные ионы. В процессе перескока щелочные металлы образуют связи с отрицательно заряженными атомами или группами атомов, образуя стабильные неорганические соединения.
Какие приложения имеет перескок щелочных металлов в неорганической химии?
Перескок щелочных металлов имеет широкий спектр приложений в неорганической химии. Один из основных способов использования перескока - это создание стабильных соединений для использования их в качестве катализаторов в реакциях между различными молекулами. Это может быть полезно, например, для синтеза новых соединений или в процессах очистки и обработки воды. Также перескок щелочных металлов может использоваться для создания электролитов для литий-ионных аккумуляторов, которые широко применяются в современных электронных устройствах.
Могут ли щелочные металлы перескочить в органической химии?
Щелочные металлы могут перескакивать не только в неорганической, но и в органической химии. В органической химии перескок щелочных металлов может использоваться для активации химических реагентов или для образования новых соединений с помощью органических молекул. Например, перескок щелочных металлов может быть использован для активации молекул органических соединений, что позволяет проводить реакции с участием сложных органических соединений и получать новые продукты.
