Степень окисления металлов – это числовое значение, которое указывает на количество электронов, переданных данному металлу при окислительно-восстановительных реакциях. Многие элементы периодической системы имеют несколько степеней окисления, что позволяет им образовывать различные соединения и принимать участие в различных реакциях.
Снятие величин степени окисления металлов главных подгрупп является важным и неотъемлемым этапом при проведении аналитических и количественных химических исследований. Оно позволяет определить степень окисления и концентрацию металла в веществе, а также провести анализ его химических свойств и реакционной способности.
Существует несколько способов снятия величин степени окисления металлов главных подгрупп, одним из которых является использование окислителей и восстановителей. Окислитель – это вещество, которое отдает электроны другому веществу и сам при этом приобретает положительный заряд, то есть понижает свою степень окисления. Восстановитель же – это вещество, которое принимает электроны из другого вещества и сам при этом приобретает отрицательный заряд, то есть повышает свою степень окисления.
Что такое величинa степеней окисления и как она снимается
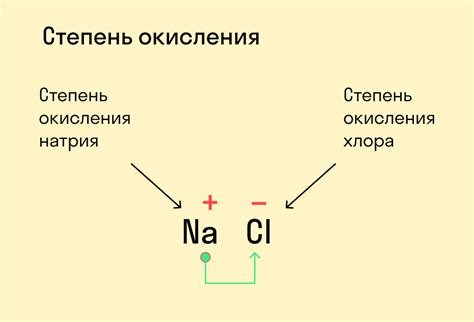
Величина степени окисления - это числовое значение, которое показывает, сколько электронов перешло от атома вещества при окислительно-восстановительной реакции. Она является ключевым показателем для определения окислительных и восстановительных свойств вещества.
Существуют различные способы снятия величин степеней окисления металлов главных подгрупп. Одним из таких способов является применение правил для определения степеней окисления на основе известных оксидов. Например, для металлов главной подгруппы I степень окисления равна +1, для металлов главной подгруппы II степень окисления равна +2.
- Еще одним способом снятия степеней окисления металлов главных подгрупп является анализ химической формулы вещества. Например, если в формуле присутствуют аммоний (NH4), то степень окисления азота равна -3, так как в NH4 содержится 4 водорода, а общая степень окисления вещества равна нулю.
- Также можно определить степень окисления металлов главных подгрупп по их положению в периодической системе. Например, для металлов главной подгруппы I степень окисления будет равна +1, так как они обладают одним электроном в внешней оболочке.
Важно отметить, что снятие величин степеней окисления металлов главных подгрупп является важным этапом при проведении реакций окисления и восстановления. Определение степени окисления позволяет взаимно связать протекающие процессы и правильно составить уравнения реакций.
Величина степени окисления и ее значение

Степень окисления представляет собой численное значение, которое показывает, сколько электронов перешло от атома одного элемента к атому другого элемента в результате окисления или восстановления. Она обозначает изменение заряда атомов в соединении и позволяет определить, какие элементы являются окислителями, а какие - восстановителями.
Величина степени окисления вещества может быть положительной, отрицательной или нулевой. Положительное значение означает, что элемент окислен и потерял электроны, отрицательное - элемент восстановлен и получил электроны, а нулевое значение указывает на отсутствие заряда и сохранение исходного состояния.
Значение степени окисления элемента определяется на основе его положения в периодической системе химических элементов и свойств соседних элементов. Например, в главной группе величина степени окисления равна заряду элемента, в переходных металлах - их положению в ряду элементов.
Знание величины степени окисления позволяет определить тип реакции, а также применять ее при балансировке химических уравнений. Также она является важным фактором при изучении реакций окисления и восстановления, которые играют важную роль в многих химических процессах, включая электролиз и коррозию металлов.
Основные правила снятия величины степени окисления
Снятие величины степени окисления металлов главных подгрупп является важным шагом в изучении химических реакций и свойств элементов. Степень окисления показывает, сколько электронов перешло от металла к другому элементу.
Один из основных правил при снятии величины степени окисления заключается в определении общего заряда соединения. Обычно, общий заряд равен нулю, так как положительный заряд металла компенсируется отрицательными зарядами других элементов. В случае ионов металла, общий заряд будет равен заряду самого иона.
Другим важным правилом является то, что в соединениях с несколькими атомами одного и того же элемента, к примеру, кислорода, его степень окисления будет одинаковой. Например, в молекуле H2O степень окисления кислорода равна -2. Таким образом, зная общий заряд соединения и степень окисления одного из элементов, можно определить степень окисления другого элемента.
Для упрощения процесса определения степени окисления металлов главных подгрупп, существуют таблицы, в которых указываются типичные значения степеней окисления для различных элементов. Однако, необходимо помнить, что в некоторых случаях степень окисления может отличаться, например, в случае комплексных соединений.
Снятие величины степени окисления для элементов главной подгруппы

Снятие величины степени окисления для элементов главной подгруппы - это процесс определения числа электронов, переданных атомом металла во время химической реакции. Это важное понятие в химии, которое позволяет понять, как происходит окислительно-восстановительное взаимодействие металлов и других веществ.
Определение величины степени окисления для элементов главной подгруппы осуществляется путем анализа их электронной конфигурации и правил электронного распределения вокруг атома. Например, для элементов главной подгруппы 1 величина степени окисления может быть равна +1, так как они имеют один валентный электрон, который они готовы отдать. А для элементов главной подгруппы 2 величина степени окисления может быть равна +2, так как они имеют два валентных электрона.
Снятие величины степени окисления для элементов главной подгруппы важно при решении различных задач в химических расчетах и прогнозировании свойств веществ. Это позволяет предсказать реакционную способность и химические свойства металлов и веществ, в которых они участвуют. Знание величины степени окисления также помогает определить, какие реакции могут протекать и какие не могут, что позволяет более эффективно планировать и контролировать химические процессы.
В целом, снятие величины степени окисления для элементов главной подгруппы - это важный этап в изучении и понимании химических реакций и свойств веществ. Оно позволяет определить реакционную способность металлов и предсказать их химические свойства, что имеет практическое применение в различных областях, включая синтез новых материалов и разработку новых технологий.
Способы определения величины степени окисления металлов главных подгрупп

Определение величины степени окисления металлов главных подгрупп является важным элементом химического анализа и позволяет оценить характер реакций и свойства соединений этих металлов. Существуют различные способы, которые можно использовать для определения этой величины.
Одним из способов является анализ структуры вещества с помощью метода рентгеноструктурного анализа. Этот метод позволяет определить расположение атомов и связей в кристаллической решетке металла и его оксида, что дает возможность определить их степень окисления.
Другим способом является определение степени окисления с помощью спектроскопических методов. Например, метод электронного поглощения позволяет определить спектры поглощения электронов веществами. Изменение спектра при окислении металла может указывать на его степень окисления.
Также можно использовать метод вольтамперометрии, который основан на измерении электрического тока, проходящего через вещество. Изменение тока при изменении степени окисления металла позволяет определить эту величину. Данные методы позволяют достаточно точно определить величину степени окисления металлов главных подгрупп и сделать выводы о свойствах соединений металлов.
Примеры снятия величины степени окисления металлов главных подгрупп

Первая главная подгруппа:
В периодической системе химических элементов первая главная подгруппа состоит из лития (Li), натрия (Na), калия (K), рубидия (Rb) и цезия (Cs). Металлы этой подгруппы имеют одну валентную электронную пару и образуют ион положительного заряда, снимая величину степени окисления +1. Например, когда литий (Li) переходит в ионное состояние, его величина степени окисления становится +1, а электронная конфигурация изменяется на 2s1.
Вторая главная подгруппа:
Вторая главная подгруппа включает элементы бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Металлы этой подгруппы имеют две валентные электронные пары и формируют ионы положительного заряда, снимая величину степени окисления +2. Например, магний (Mg) переходит в ионное состояние с величиной степени окисления +2 и электронной конфигурацией 2s2.
Третья главная подгруппа:
Третья главная подгруппа включает элементы скандий (Sc), иттрий (Y), лантан (La) и актиний (Ac). Металлы этой подгруппы имеют три валентные электронные пары и образуют ионы положительного заряда, снимая величину степени окисления +3. Например, скандий (Sc) переходит в ионное состояние с величиной степени окисления +3 и электронной конфигурацией 3d14s2.
Четвертая главная подгруппа:
Четвертая главная подгруппа состоит из титана (Ti), зиркония (Zr), гафния (Hf) и резерфордия (Rf). Металлы этой подгруппы имеют четыре валентные электронные пары и формируют ионы положительного заряда, снимая величину степени окисления +4. Например, оксид титана (TiO2) содержит титан с величиной степени окисления +4 и электронной конфигурацией 3d24s2.
Значение снятия величины степени окисления металлов главных подгрупп в химии

Снятие величины степени окисления металлов главных подгрупп играет важную роль в химии и находит применение в различных областях. Основное значение этого процесса заключается в определении количества электронов, которые переносятся от металла к другому веществу в химической реакции.
Снятие величины степени окисления металлов главных подгрупп позволяет определить химические свойства и возможности металлов во взаимодействии с другими веществами. Оно помогает предсказать реакционную способность металла, его способность образовывать соединения с различными степенями окисления.
Снятие величины степени окисления металлов главных подгрупп также позволяет определить его расположение в периодической системе элементов и классифицировать его по категориям. Это позволяет систематизировать знания о металлах и упростить процесс изучения химии в целом.
В химических реакциях снятие величины степени окисления металлов главных подгрупп является первым и важным этапом. Оно позволяет определить, по какому пути протекает реакция и в какую сторону движется электронный поток. Благодаря этому, ученые могут предсказывать, какие последующие реакции могут произойти и каков будет конечный результат.
Вопрос-ответ

Что такое степень окисления металлов главных подгрупп?
Степень окисления металлов главных подгрупп - это числовое значение, которое указывает на количество электронов, которые металл отдал или принял при образовании соединения. Она может быть положительной, отрицательной или равной нулю.
Зачем нужно знать степень окисления металлов главных подгрупп?
Знание степени окисления металлов главных подгрупп позволяет определить их активность в химических реакциях, а также предсказать возможные способы восстановления или окисления данных металлов.
Какие металлы относятся к главным подгруппам?
К главным подгруппам относятся металлы из I, II и III, IV, V и VI групп периодической системы элементов. Например, натрий, калий, магний, кальций и многие другие.
Что такое снятие величины степени окисления металлов главных подгрупп?
Снятие величины степени окисления металлов главных подгрупп - это процесс, при котором металл увеличивает свою степень окисления путем отбирания электронов от других веществ. Это может происходить в реакциях с кислородом, галогенами и другими окислителями.
Какие могут быть способы снятия величины степени окисления металлов главных подгрупп?
Снятие величины степени окисления металлов главных подгрупп может происходить различными способами, включая реакцию с кислородом, получение с металлами сводных высших окислов, реакция с галогенами и другими окислителями, а также электрохимические методы.
