Металлы являются одной из основных групп веществ, известных человечеству с древних времен. Они обладают уникальными химическими и физическими свойствами, которые определяют их широкое применение в различных областях науки и техники. Одним из ключевых аспектов, определяющих свойства металлов, является их атомное строение.
Атомы металлов отличаются от атомов других элементов особыми характеристиками. Во-первых, они обладают меньшей электроотрицательностью, что позволяет им образовывать межатомные связи с другими атомами. Во-вторых, у металлов есть выраженная способность образовывать кристаллическую решетку, которая обеспечивает устойчивость и прочность металлических материалов.
Основной структурный элемент металлической решетки - это атом металла. Он обладает несколькими важными особенностями. Во-первых, металлический атом имеет относительно большой радиус, что позволяет свободное движение его электронов. Во-вторых, металлический атом содержит в своей внешней оболочке небольшое количество электронов, что делает его склонным отдавать эти электроны и образовывать положительно заряженные ионы.
Изучение строения атомов металлов позволяет лучше понять их свойства и способы взаимодействия с другими веществами. Оно является основой для расширения сферы применения металлических материалов и создания новых технологий.
Основные характеристики и строение атомов металлов
Атомы металлов являются основной структурной единицей металлических материалов. Они обладают рядом характеристик, которые определяют их особенности и свойства.
Первая характеристика – металлическая связь. Атомы металлов образуют кристаллическую решетку, в которой положительно заряженные ионы металла окружены общими электронами. Это позволяет атомам соединяться друг с другом сильными межатомными связями и образовывать кристаллические структуры с высокой упругостью и пластичностью.
Вторая характеристика – валентность. Атомы металлов обладают переменной степенью окисления, что позволяет им образовывать соединения с различными элементами. Валентность металлов определяет количество электронов, которые атом может отдать или принять при образовании химических связей, что влияет на их реактивность и способность к образованию разнообразных соединений.
Третья характеристика – так называемый «море электронов». Атомы металлов обладают свободными электронами в валентной оболочке, которые могут передвигаться по кристаллической решетке. Это формирует так называемую электронную оболочку или «море электронов», которая обеспечивает проводимость электрического тока и теплопроводность металлов.
Таким образом, строение атомов металлов – это не просто отдельные частицы, а сложная система взаимодействия атомов и свободных электронов, определяющая особенности и свойства металлических материалов.
Общая информация

Атомы металлов являются основными строительными блоками металлических материалов. Они отличаются от атомов неметаллов своим строением и свойствами.
Атомы металлов обладают большим количеством свободных электронов, что делает их проводниками электричества и тепла. Это объясняет множество металлических свойств, таких как эластичность, пластичность и способность к формированию различных структур при обработке.
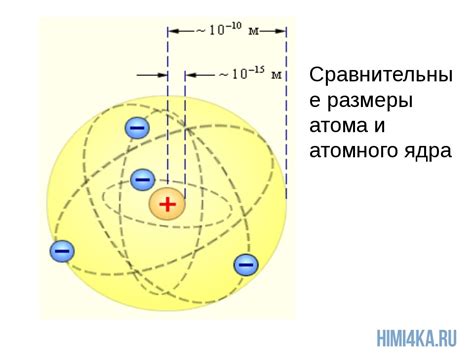
Строение атомов металлов характеризуется наличием ядра, состоящего из протонов и нейтронов, а также облака электронов, вращающихся вокруг ядра. Электроны находятся в нескольких энергетических уровнях или оболочках, каждая из которых имеет ограниченное количество электронов. Первая оболочка может содержать до 2 электронов, вторая - до 8 электронов и так далее.
Атомы металлов также характеризуются наличием внешней оболочки, которая содержит меньшее количество электронов, чем максимально допустимое количество. Это делает атомы металлов нестабильными и склонными к образованию химических связей с другими атомами, чтобы заполнить свою внешнюю оболочку и стабилизироваться.
Строение атомов металлов определяет их химические и физические свойства, включая степень твердости, плавучесть, температуру плавления и кипения, а также способность образовывать сплавы и легировать другие материалы.
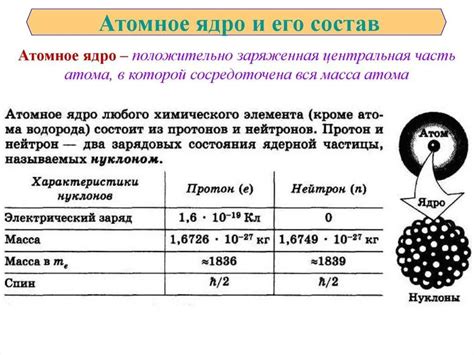
Ядро атома металла
Ядро атома металла является центральной частью атома, содержащей положительно заряженные протоны и нейтроны. Протоны имеют положительный электрический заряд, а нейтроны не имеют заряда и являются неподвижными частицами.
Число протонов в ядре атома определяет его атомный номер, который является характеристикой химического элемента. Атомы разных элементов имеют разное число протонов в ядре и, следовательно, разный атомный номер.
Наиболее известными металлами являются железо, алюминий, медь, свинец, золото и другие. У атомов металлов ядра обладают большим количеством протонов и нейтронов, что объясняет их относительно большую массу.
В ядро атома металла также входят электроны, которые обращаются по орбитам вокруг ядра. Однако, масса электронов намного меньше массы протонов и нейтронов, поэтому они не вносят существенный вклад в общую массу атома.
Ядро атома металла отвечает за его стабильность и электромагнитные свойства. При разных условиях и химических реакциях, ядро может подвергаться изменениям, что приводит к образованию изотопов и изменению химических свойств металла.
Таким образом, ядро атома металла является фундаментальной частью его строения и определяет его химические и физические свойства.
Электронная оболочка
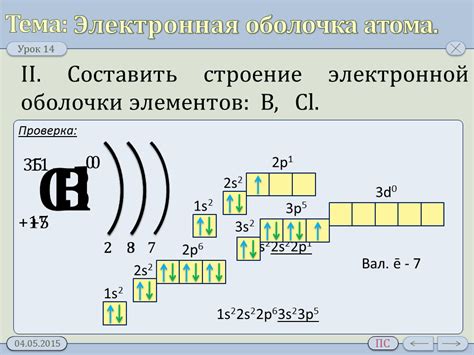
Электронная оболочка – это наружная структура атома металла, состоящая из электронов, которые образуют электронные слои. Количество электронов в каждом слое определяется по формуле 2n^2, где n - номер слоя. Наиболее внешний слой атома называется валентным слоем и отвечает за химическую активность металла.
Электроны в оболочке атома металла располагаются по энергетическим уровням, которые характеризуются орбиталями. Орбитали – это пространственные области, в которых существует наибольшая вероятность обнаружить электрон. Орбитали имеют разную форму и вместимость: s-орбиталь может содержать до 2 электронов, p-орбиталь – до 6 электронов, d-орбиталь – до 10 электронов, f-орбиталь – до 14 электронов.
Основные энергетические уровни атома металла обозначаются буквами K, L, M и далее по алфавиту. На каждом уровне располагается определенное количество подуровней и орбиталей. Например, на уровне K есть только один s-подуровень, на уровне L – один s-подуровень и три p-подуровня, на уровне M – один s-подуровень, три p-подуровня и пять d-подуровней, и так далее.
Валентные электроны и свойства металлов

Валентные электроны в атомах металлов находятся на последней энергетической оболочке. Они обладают высокой подвижностью и легко участвуют в химических реакциях. Валентные электроны определяют основные свойства металлов.
Одним из основных свойств металлов является электропроводность. Валентные электроны свободно перемещаются внутри металлической решетки, образуя так называемый "электронный газ". Благодаря этому металлы легко проводят электрический ток.
Другим важным свойством металлов является их пластичность. Валентные электроны сильно связаны с положительно заряженными ионами металла, что позволяет атомам смещаться друг относительно друга без изменения их взаимного расположения. Это позволяет металлам легко поддаваться деформации и формировать различные изделия.
Также металлы обладают высокой теплопроводностью. Она обусловлена способностью валентных электронов передавать энергию в виде тепла другим электронам. Металлы быстро нагреваются и охлаждаются, что делает их полезными материалами в различных отраслях, связанных с тепловыми процессами.
Кроме того, металлы характеризуются высокой удельной теплоёмкостью. Это свойство объясняется большим числом энергетических уровней валентных электронов, которые могут принимать дополнительную энергию в виде тепла.
Таким образом, валентные электроны играют ключевую роль в определении основных свойств металлов, таких как электропроводность, пластичность, теплопроводность и удельная теплоёмкость.
Сложение атомов металлов в кристаллическую решетку
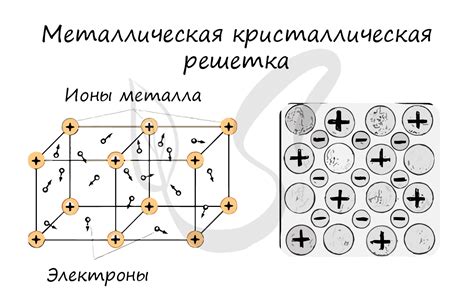
Металлы обладают специфической структурой – кристаллической решеткой. В кристаллической решетке атомы металла упорядочены и расположены в определенном порядке. Структура кристаллической решетки определяет многие свойства металлов, такие как прочность, пластичность и проводимость электричества.
Сложение атомов металлов в кристаллическую решетку происходит благодаря особенностям взаимодействия атомов. Атомы металла обладают свободными электронами, которые образуют так называемое "электронное облако". Эти электроны между атомами металла образуют своеобразные связи, называемые "металлическими связями". Это позволяет атомам металла слипаться в компактную структуру – кристаллическую решетку.
Кристаллическая решетка металлов часто является очень плотной и упорядоченной, что обусловливает их характерные металлические свойства. Атомы металлов в решетке расположены на определенных расстояниях друг от друга, что делает металлы твердыми и прочными. В то же время, достаточно большое количество свободных электронов позволяет металлам быть хорошими проводниками электричества и тепла.
Источником упорядоченности в кристаллической решетке металлов является взаимодействие атомных ядер и свободных электронов, которые занимают энергетические уровни в решетке. Именно электронная структура металлов определяет их свойства и поведение в различных условиях.
Влияние строения атомов на свойства металлов

Строение атомов металлов определяется особенностями их электронной оболочки. У металлов на внешнем энергетическом уровне находятся от 1 до 3 электронов, что делает их восприимчивыми к образованию металлической связи. Атомы металлов обладают большими размерами и низкой электроотрицательностью.
Строение атомов металлов влияет на их физические и химические свойства. Атомы металлов обладают высокой подвижностью своих электронов, что обусловливает хорошую электропроводность и теплопроводность металлов. Кроме того, металлическая связь обеспечивает высокую пластичность и деформируемость металлов.
Строение атомов металлов также влияет на их магнитные свойства. Некоторые металлы, такие как железо, никель и кобальт, образуют кристаллическую решетку, в которой атомы выстраиваются в определенном магнитном порядке. Это делает эти металлы магнитными. Другие металлы, такие как алюминий и магний, не образуют такой порядок и не обладают магнитными свойствами.
Строение атомов металлов также влияет на их температурные свойства. Металлы имеют высокую теплопроводность и точку плавления благодаря свободному движению электронов в их структуре. Атомы металлов с большим количеством путей для передачи энергии между ними имеют высокую теплопроводность и могут выдерживать высокие температуры без разрушения.
Вопрос-ответ

Какова структура атомов металлов?
Атомы металлов имеют особую структуру. Они состоят из ядра, в котором находятся протоны и нейтроны, а вокруг ядра движутся электроны.
Что такое ядро атома металла?
Ядро атома металла - это его центральная часть, состоящая из протонов и нейтронов. Протоны имеют положительный заряд, а нейтроны не имеют заряда.
Какие еще частицы содержатся в атоме металла?
Помимо ядра, в атоме металла находятся электроны. Электроны имеют отрицательный заряд и движутся по определенным орбитам вокруг ядра.
Чем отличается строение атомов металлов от строения атомов других веществ?
Основное отличие строения атомов металлов от других веществ заключается в наличии свободных электронов, которые могут перемещаться между атомами и создавать электрический ток. Это делает металлы хорошими проводниками электричества и тепла.
