Щелочноземельные металлы – это группа элементов периодической системы, которые обладают рядом особенностей, отличающих их от других элементов. В их состав входят бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Хотя эти металлы имеют много общих свойств, каждый из них также обладает своими уникальными характеристиками.
Важной особенностью щелочноземельных металлов является их высокая реактивность. Они реагируют со многими веществами, включая воду, кислород и некоторые другие элементы. Например, бериллий реагирует с кислородом, образуя окись бериллия, которая обладает высокой температурной стабильностью. Кроме того, магний реагирует с водой, образуя гидроксид магния и высвобождая водород.
Другой важной особенностью щелочноземельных металлов является их низкая плотность. Это означает, что они отлично плавают на поверхности воды. Например, стронций имеет плотность всего 2,64 г/см³, что делает его легче воды. Из-за этой особенности, щелочноземельные металлы можно найти в природе как минералы, такие как доломит и магнезит.
Кроме того, щелочноземельные металлы имеют высокую пунктуальную энергию – это означает, что они являются хорошими проводниками электричества. Барий, например, имеет очень низкое сопротивление, что делает его отличным материалом для производства проводников. Кроме того, эти металлы имеют высокую теплопроводность, что делает их полезными для применения в тепловых и энергетических системах.
Итак, щелочноземельные металлы отличаются высокой реактивностью, низкой плотностью и высокой пунктуальной энергией, что делает их непохожими на другие элементы. Эти уникальные особенности делают их полезными для широкого спектра применений в различных областях науки и техники.
Особенности химических свойств щелочноземельных металлов

Щелочноземельные металлы - это группа элементов в периодической системе, включающая бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Как и другие металлы, щелочноземельные металлы обладают высокой теплопроводностью, электропроводностью и пластичностью. Однако, они также обладают некоторыми особенностями, которые делают их непохожими на другие элементы.
Первой особенностью щелочноземельных металлов является их низкая плотность. В сравнении с другими металлами, такими как железо или свинец, щелочноземельные металлы имеют относительно низкую плотность, что делает их легкими и удобными в использовании.
Другой особенностью щелочноземельных металлов является их высокая реактивность. Они активно взаимодействуют с водой или кислотами, образуя гидроксиды или соли. Бериллий, однако, является исключением из этого правила, так как он реагирует лишь с концентрированными кислотами или щелочами.
Щелочноземельные металлы обладают ярко-выраженными металлическими свойствами, такими как блеск и тугоплавкость. Они плавятся при относительно низких температурах и имеют низкую теплоту плавления.
Еще одной интересной особенностью щелочноземельных металлов является их высокий энергетический потенциал. В результате этого они широко используются в различных технологиях, таких как производство алюминия, магниевых сплавов и других материалов, а также в производстве батарей и электроники.
- Щелочноземельные металлы обладают низкой плотностью
- Они высоко реактивны
- Обладают металлическим блеском и тугоплавкостью
- Щелочноземельные металлы имеют высокий энергетический потенциал
Уникальные электронные и ионные свойства щелочноземельных металлов
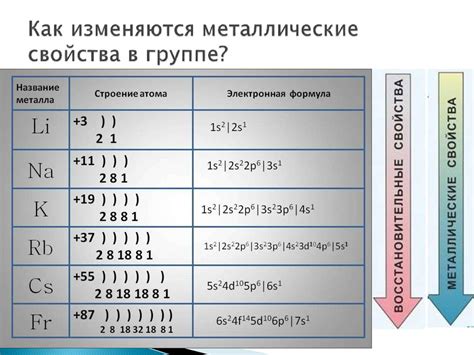
Щелочноземельные металлы - это элементы второй группы периодической системы. Они обладают рядом уникальных электронных и ионных свойств, которые делают их непохожими на другие элементы.
Одной из важных особенностей щелочноземельных металлов является их низкая электроотрицательность. Это значит, что они имеют высокую склонность отдавать электроны, образуя положительные ионы. Благодаря этому свойству, щелочноземельные металлы легко реагируют с другими веществами и образуют различные соединения.
Еще одной особенностью щелочноземельных металлов является их низкая энергия ионизации. Это означает, что энергия, необходимая для удаления электрона с атома щелочноземельного металла, очень мала. Именно поэтому эти металлы образуют ионы с многократным положительным зарядом, что делает их ионы очень стабильными и реакционно способными.
Кроме того, одной из интересных особенностей щелочноземельных металлов является их способность образовывать специфические соединения с водой. При прямом контакте с водой, щелочноземельные металлы реагируют с ней, образуя гидроксиды, которые обладают щелочными свойствами. Такие реакции с водой являются важными для процессов, происходящих в природе и в технологических процессах.
Таким образом, уникальные электронные и ионные свойства щелочноземельных металлов, такие как высокая склонность отдавать электроны, низкая энергия ионизации и способность образовывать специфические соединения с водой, делают их непохожими на другие элементы и придают им особую роль в химических реакциях и естественных процессах.
Высокая реактивность и неустойчивость
Щелочноземельные металлы - это группа химических элементов в периодической таблице, включающая бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Они обладают рядом особенностей, которые делают их непохожими на другие элементы.
Одной из главных характеристик щелочноземельных металлов является их высокая реактивность. Они легко вступают в химические реакции, особенно с кислородом, водой и некоторыми другими веществами. Например, реакция магния с кислородом приводит к образованию оксида магния, который в свою очередь может быть использован в процессе получения магния. Такая реактивность щелочноземельных металлов связана с особенностями их электронной структуры.
Важно отметить, что щелочноземельные металлы также обладают неустойчивостью. Они очень чувствительны к воздействию воды и влаги, поскольку они легко реагируют с водой, приводя к образованию гидроксидов и выделению водорода. Например, реакция кальция с водой приводит к образованию гидроксида кальция и выделению водорода. Это делает их хрупкими и неустойчивыми в окружающей среде, требуя специальных условий и мер предосторожности при их хранении и использовании.
В заключение, высокая реактивность и неустойчивость щелочноземельных металлов делают их особенными и отличными от других элементов. Их способность вступать в химические реакции с различными веществами и их чувствительность к воде и влаге оказывают существенное влияние на их использование и обработку.
Химическая активность и реактивность в воде

Щелочноземельные металлы, такие как бериллий, магний, кальций, стронций, барий и радий, проявляют химическую активность и реактивность в воде. Несмотря на то, что они не являются такими реактивными, как щелочные металлы, они все равно имеют склонность к химическому взаимодействию с водой.
Бериллий очень реактивен в воде и реагирует с ней, выделяя водород. Этот процесс может быть достаточно интенсивным и может сопровождаться выделением горячей и вспышки.
Магний реагирует с водой медленно, особенно при комнатной температуре. Реакция магния в воде происходит с выделением водорода и образованием гидроксида магния (Mg(OH)₂). Гидроксид магния плохо растворим в воде, поэтому его осадок может образовать непрозрачные или мутные растворы.
Кальций реагирует с водой, но реакция происходит значительно медленнее, чем у магния. Реакция кальция в воде также сопровождается выделением водорода и образованием гидроксида кальция (Ca(OH)₂). Гидроксид кальция не растворяется в воде, и поэтому он может образовывать осадок на поверхности.
Стронций, барий и радий находятся ниже в ряду щелочноземельных металлов и проявляют схожую химическую активность. Они реагируют с водой, образуя гидроксиды соответствующих металлов (Sr(OH)₂, Ba(OH)₂, Ra(OH)₂). Реакция этих металлов с водой также сопровождается выделением водорода.
Общим свойством реакции щелочноземельных металлов с водой является образование гидроксидов и выделение водорода. При этом скорость реакции и эксплозивность процесса может зависеть от конкретного металла. Реактивность металлов также может изменяться в зависимости от условий, таких как температура и концентрация раствора.
Вопрос-ответ

Чем щелочноземельные металлы отличаются от других элементов?
Щелочноземельные металлы отличаются от других элементов своей реактивностью и свойствами. Они являются мягкими металлами с низкой плотностью и небольшой температурой плавления. Кроме того, они обладают высокой электропроводностью и способностью образовывать множество соединений с различными элементами. Однако, в отличие от щелочных металлов, щелочноземельные металлы менее реактивны и образуют более стабильные соединения.
Какие особенности делают щелочноземельные металлы уникальными?
Щелочноземельные металлы обладают несколькими особенностями, которые делают их уникальными. Во-первых, они являются легкими, мягкими и хорошо деформируемыми металлами. Они также обладают отличной термической и электрической проводимостью. Во-вторых, щелочноземельные металлы образуют стабильные соединения, что позволяет им находить применение в различных областях науки и техники. Например, магний применяется в авиации и автомобильной промышленности, кальций используется для производства цемента, а стронций – в ядерной энергетике.
Какие свойства щелочноземельных металлов делают их непохожими на другие элементы?
У щелочноземельных металлов есть несколько свойств, которые делают их непохожими на другие элементы. Во-первых, они имеют низкую плотность, что означает, что они легкие и имеют малую массу в единицу объема. Во-вторых, они обладают низкой температурой плавления, что позволяет им легко переходить из твердого состояния в жидкое при повышении температуры. Кроме того, щелочноземельные металлы обладают высокой электропроводностью и могут образовывать стабильные соединения с другими элементами. Все эти свойства делают их уникальными и полезными в различных областях науки и техники.
