Металлы являются одним из основных классов химических элементов, известных человечеству. Они обладают рядом уникальных химических свойств, которые позволяют им выделяться на фоне других элементов. Проявление этих свойств обусловлено как их строением и электронной структурой, так и взаимодействием с другими веществами.
Одной из основных причин проявления химических свойств металлов является их внутренняя структура. Металлы обладают кристаллической решеткой, в которой положительно заряженные ионы металла расположены в регулярном порядке и окружены облаком свободно движущихся электронов. Это облегчает передачу электронов и обуславливает хорошую электропроводность металлов.
Взаимодействие металлов с другими веществами обусловлено их способностью образовывать ионы различных зарядов. Металлы часто образуют положительно заряженные ионы, отдавая электроны, например, в реакциях с кислородом или кислотами. Они также обладают высокой химической активностью, способностью образовывать соединения с другими элементами и веществами.
Механизмы проявления химических свойств металлов могут различаться в зависимости от конкретного элемента и условий, но обычно включают образование соединений с другими элементами, окисление и восстановление, а также реакции с кислотами и основаниями. В результате этих реакций металлы могут образовывать разнообразные соединения, от карбидов до солей, и проявлять различные свойства, как металлические, так и неметаллические.
Проявление химических свойств металлов

Металлы обладают рядом уникальных химических свойств, которые определяют их поведение при взаимодействии с другими веществами. Одной из основных характеристик металлов является их способность формировать положительные ионы, или катионы, в растворах и химических реакциях.
Процесс образования катионов у металлов происходит за счет отдачи одного или нескольких электронов из внешней оболочки атома. В результате этого происходит образование положительно заряженных ионов, которые способны образовывать связи с другими атомами или ионами.
Катионы металлов обладают свойством притягивать к себе отрицательно заряженные частицы, что определяет множество их реакций. Например, металлы могут образовывать соли с кислотами, при этом катионы металлов образуют кристаллическую решетку с анионами кислоты.
Кроме того, металлы также обладают способностью образовывать сплавы при взаимодействии с другими металлами или амальгамы с ртутью. Это свойство объясняется их способностью легко перемещаться в решетке кристалла и занимать пустые места в кристаллической структуре другого металла или ртути.
Проявление химических свойств металлов также связано с их атомным строением. Металлы обладают особой электронной структурой, которая представляет собой большое количество электронов в валентной оболочке. Это позволяет атомам металлов образовывать связи с другими атомами и ионами, что обеспечивает их реакционную способность и приспосабливаемость к различным условиям.",
Физическая природа

Физическая природа проявления химических свойств металлов определяется их электронной структурой и специфическими особенностями химических связей в кристаллической решетке.
В электронной структуре металлов наружным электронным оболочкам присутствует от одного до трех "свободных" электронов. Они легко отдаются или принимаются другими элементами, что обуславливает их высокую реакционную способность и химическую активность. Это свойство позволяет металлам образовывать ионы и привлекать к себе электроны от других элементов.
Специфические особенности химических связей в кристаллической решетке металлов создают условия для их высокой теплопроводности, электропроводности и пластичности. Металлы состоят из заряженных положительно ядер и "облаков" электронов, свободно движущихся между атомами. Это облегчает передачу тепла и электричества в кристаллической решетке металла.
Кроме того, металлы обладают высокой пластичностью, то есть способностью изменять свою форму без разрушения структуры. В кристаллической решетке металлов атомы располагаются в регулярном порядке, формируя многоуровневые слои. Это обуславливает возможность скольжения атомов друг относительно друга, что позволяет металлам легко деформироваться и принимать различные формы.
Электронная структура
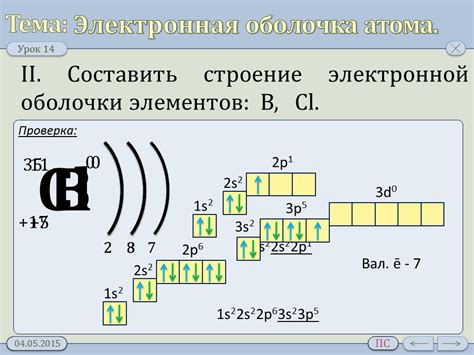
Электронная структура является основной причиной проявления химических свойств металлов. Металлы отличаются от других элементов тем, что у них внешний электронный уровень содержит от одного до трех электронов. Это делает металлы хорошими проводниками электричества и тепла.
Проводимость металлов основана на свободном движении электронов внешнего уровня. Электроны в металлах образуют так называемое "море электронов", которое состоит из отрицательно заряженных свободных электронов. Благодаря этому, металлы легко проводят электрический ток и тепло.
В атомах металлов внешний электронный уровень обычно заполнен не до конца. Такая структура позволяет электронам на этом уровне легко перемещаться между атомами и образовывать связи с другими элементами. Это объясняет высокую реакционную способность металлов и их способность образовывать соединения со многими другими веществами.
Кроме того, электронная структура металлов влияет на их физические свойства, такие как пластичность и тугоплавкость. Способность металлов легко поддаваться деформации связана с их способностью электронного облака адаптироваться к изменяющимся условиям.
Тенденции в периодической системе
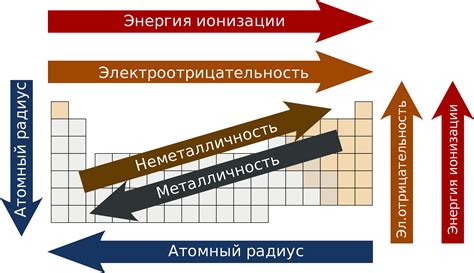
Периодическая система химических элементов является важным инструментом для организации и классификации элементов. Одной из интересных особенностей периодической системы являются тенденции, которые можно наблюдать при перемещении по периодам и группам.
В периоде, расположенном слева от периодической таблицы, элементы имеют низкую электроотрицательность и отдают электроны во внешний энергетический уровень, образуя катионы. Это объясняет их активность и способность к реакциям с неактивными неметаллами. При перемещении по периоду электроотрицательность элементов увеличивается, что делает их более реактивными и способными образовывать анионы путем приобретения электронов.
Группы в периодической системе имеют сходную химическую реактивность из-за одинакового числа электронов на внешних энергетических уровнях. Например, элементы в первой группе имеют один валентный электрон и образуют однозарядные катионы, а элементы во второй группе имеют два валентных электрона и образуют двухзарядные катионы.
Другой тенденцией в периодической системе является изменение размера атомов. В периоде размеры атомов возрастают при перемещении слева направо из-за увеличения числа энергетических уровней. В группе размеры атомов увеличиваются при перемещении сверху вниз из-за увеличения числа электронных оболочек.
Некоторые элементы также имеют особые тенденции. Например, элементы переходных металлов в середине периодической таблицы обладают высокой плотностью, тугоплавкостью и способностью образовывать комплексные соединения. Эти свойства связаны с их частичным заполнением d-подуровней.
Ионы и их реактивность
Ионы являются заряженными атомами и играют важную роль в реакциях металлов. Реактивность ионов определяется их зарядом и радиусом.
Заряд иона влияет на его способность участвовать в реакциях. Ионы с положительным зарядом, называемые катионами, обычно обладают большей реактивностью, поскольку стремятся снизить свой положительный заряд путем передачи электронов другим веществам. С другой стороны, ионы с отрицательным зарядом, называемые анионами, меньше склонны к реакциям из-за своей негативной зарядной плотности.
Также важным фактором является радиус иона. Ионы с маленьким радиусом имеют большую зарядовую плотность и, следовательно, большую реактивность. Это связано с тем, что ионы с маленьким радиусом легче взаимодействуют с другими веществами, так как их заряды сосредоточены на меньшей площади.
Определенные группы ионов обладают специфической реактивностью. Например, ионы некоторых металлов, таких как натрий или калий, легко реагируют с водой, образуя гидроксиды и выделяя водород. Другие металлы, например железо или алюминий, реагируют с кислотами, образуя соли и выделяя водород. Эти реакции обусловлены способностью ионов металлов вступать в обменные реакции с другими атомами или ионами.
Взаимодействие металлов с кислородом и водой

Металлы характеризуются различной степенью активности во взаимодействии с кислородом и водой. Вязкостью металлы разделяют на активные (стронций, кальций, натрий), устойчивые (железо, алюминий, медь) и инертные (золото, платина).
Реакция металлов с кислородом происходит в результате окисления. Металлы активной группы, такие как натрий и калий, окисляются очень легко воздухом с образованием оксида металла. Устойчивые металлы, такие как железо и алюминий, имеют высокую степень устойчивости к окислению и покрываются пленкой оксида, которая предотвращает дальнейшее окисление.
Вода также взаимодействует с металлами. Активные металлы реагируют с водой, образуя оксид металла и выделяя водород. Например, натрий реагирует с водой, образуя гидроксид натрия и выделяя водород. Устойчивые металлы не реагируют с водой под обычными условиями, но при повышенной температуре или под действием катализатора они могут вступать в реакцию. Инертные металлы, такие как золото и платина, не взаимодействуют с водой в обычных условиях.
Таким образом, взаимодействие металлов с кислородом и водой зависит от их активности и степени устойчивости к окислению. Эти химические реакции определяют химические свойства металлов и их практическое применение.
Коррозия и защита от коррозии

Коррозия является проявлением химических свойств металлов, которые приводят к их повреждению и разрушению в результате взаимодействия с окружающей средой. Основной причиной коррозии является окисление металла, что приводит к образованию оксидов и гидроксидов. Этот процесс может быть ускорен различными факторами, такими как влажность, наличие кислорода, агрессивных химических веществ и т.д.
Для защиты от коррозии применяются различные методы, включая покрытие поверхности металла защитным слоем. Одним из таких методов является нанесение жгута на поверхность металла, который создает барьер между металлом и окружающей средой, предотвращая взаимодействие. Этот метод широко используется при защите железобетонных конструкций.
Еще одним методом защиты от коррозии является использование антикоррозионных покрытий. Эти покрытия обеспечивают создание защитного слоя на поверхности металла, который предотвращает контакт с агрессивными средами. Покрытия могут быть нанесены методом окрашивания, нанесения порошка, гальваническим покрытием и другими способами.
Также существует метод электролитической защиты от коррозии. Он основан на использовании гальванической пары, состоящей из двух металлов с различными потенциалами окисления. Благодаря этому в процессе коррозии тот металл, который имеет более высокий потенциал окисления, служит анодом, а металл с нижним потенциалом - катодом. Таким образом, металлы снижают скорость коррозии друг друга.
Важным методом защиты от коррозии является также контроль окружающей среды. Снижение влажности, удаление кислорода из окружающей среды, использование антикоррозионных добавок и других мероприятий позволяют предотвратить возникновение коррозии и сохранить металлические конструкции в течение длительного времени.
Вопрос-ответ

Какие факторы влияют на проявление химических свойств металлов?
Проявление химических свойств металлов зависит от нескольких факторов, включая их электронную структуру, заряд ядра и наличие свободных электронов в валентной зоне.
Почему металлы обычно проявляют активность в химических реакциях?
Металлы проявляют активность в химических реакциях из-за того, что валентные электроны, находящиеся в более высоких энергетических уровнях, слабо связаны с атомом и могут легко участвовать в химических переходах. Это позволяет металлам образовывать ионные и ковалентные связи с другими элементами и соединениями.
Каким образом заряд ядра влияет на проявление химических свойств металлов?
Заряд ядра влияет на проявление химических свойств металлов путем определения электронной структуры и энергетических уровней в атоме. Чем больше заряд ядра, тем сильнее притягиваются валентные электроны к ядру, что делает их менее доступными для участия в химических реакциях. Но наличие свободной электронной оболочки компенсирует этот эффект и позволяет металлам проявлять активность в химических реакциях.
Как происходит образование ионов металлов?
Образование ионов металлов происходит путем потери валентных электронов. Ионы металлов обычно имеют положительный заряд, который равен числу потерянных электронов. Процесс образования ионов металлов может быть ионным или ковалентным, в зависимости от природы взаимодействия с другими элементами и соединениями.
