Электропроводность металлов является одной из их основных химических характеристик. Она обеспечивает возможность передачи электрического тока через металлическую среду. Такая способность обусловлена особыми свойствами структуры и химического состава металлов.
Металлы состоят из регулярной решетки положительно заряженных атомных ядер и свободных электронов, движущихся между ними. Особенностью металлической структуры является отсутствие прочных химических связей между атомами, которые присутствуют, например, в ковалентных или ионных соединениях. В металлах свободные электроны создают «море электронов», которое может свободно передвигаться по всей металлической среде.
Такая особенность структуры металлов позволяет электронам легко двигаться под действием электрического поля. В результате приложения внешнего электрического поля электроны начинают двигаться в направлении отрицательно заряженного конца проводника к положительно заряженному концу. Таким образом, металлы обладают высокой электропроводностью, что делает их идеальными материалами для проводников электрического тока.
Путь к пониманию электропроводности металлов

Электропроводность металлов представляет собой способность материала проводить электрический ток. Понимание причин этого явления было результатом множества исследований и открытий в области химии.
Одним из первых этапов в понимании электропроводности металлов было открытие электролитических реакций. Исследования, начавшиеся в 18 веке, позволили установить, что металлы содержат свободно движущиеся электрические частицы, отвечающие за электропроводность.
Дальнейшие исследования привели к открытию электронов. В начале 20 века физики Джозеф Лармор и Эрнест Резерфорд определили структуру атома и открыли, что электропроводность металлов обусловлена свободными электронами, движущимися по металлической решетке.
Химический аспект электропроводности металлов заключается в особой структуре металлической решетки и связи между атомами. Металлы характеризуются кристаллической решеткой, в которой положение атомов регулярно повторяется. Это позволяет электронам свободно перемещаться и передавать электрический заряд.
Одной из важных характеристик металлов является их электронная структура. Металлы обладают низкой электроотрицательностью, что обуславливает слабость связи между атомами. Благодаря этому электроны сравнительно легко оставляют свои атомы и двигаются по решетке металла, обеспечивая его электропроводность.
Влияние химической структуры на электропроводность
Электропроводность металлов обусловлена их особой химической структурой. Металлы обладают свободными электронами, которые могут свободно перемещаться внутри материала. Это объясняет их хорошую электропроводность.
Химическая структура металлов состоит из кристаллической решетки, в которой атомы расположены регулярно и образуют металлические связи. В данной структуре электроны образуют "облако", которое окружает атомы металла. Это облако состоит из свободных электронов, которые находятся в постоянном движении.
Влияние химической структуры на электропроводность металлов проявляется через такие химические параметры, как межатомные расстояния, размеры атомов и их заряды. Например, металлы с большими атомами имеют большие межатомные расстояния, что приводит к увеличению расстояния между свободными электронами и, следовательно, к уменьшению электропроводности.
Также химическая структура металлов влияет на их теплопроводность и механическую прочность. Например, добавление других элементов в металлическую решетку может улучшить механические свойства материала, но при этом может уменьшить его электропроводность.
Выводя исследование на уровень параметров, можно сказать, что электропроводность металлов зависит от их химической структуры, что в свою очередь определяется составом и их областями применения.
Электропроводность металлов и их атомная структура
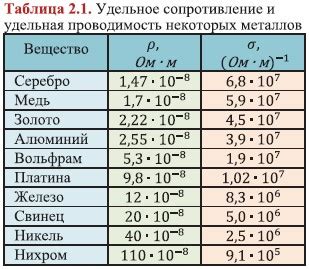
Металлы обладают высокой электропроводностью, что обусловлено их особой атомной структурой. В отличие от неметаллов и полупроводников, атомы металлов образуют кристаллическую решетку, в которой позитивно заряженные ядра атомов окружены свободно движущимися электронами.
Валентные электроны металлов находятся в щелевых или диффузионных энергетических зонах, что позволяет им легко перемещаться по кристаллической решетке и образовывать электрический ток. Электроны в металлах могут перемещаться как постепенно, так и свободно, в зависимости от конкретной структуры металла.
Одной из важнейших характеристик металлов, определяющих их электропроводность, является концентрация свободных электронов. Чем выше концентрация электронов, тем больше вероятность их столкновений и тем выше электропроводность металла.
Следует отметить, что электропроводность металлов может меняться при изменении различных факторов, таких как температура, примеси или механическое напряжение. Например, при повышении температуры электрическое сопротивление металла обычно увеличивается из-за увеличения внутримолекулярных колебаний атомов.
Электропроводность металлов и химические связи

Электропроводность металлов определяется их особыми химическими связями - металлическими связями. Эти связи образуются между атомами металла и играют ключевую роль в обусловливании электропроводности.
Металлические связи основаны на обмене электронами между атомами металла. Атомы металла сами по себе содержат небольшое количество электронов в своих внешних энергетических оболочках, это называется "электронной оболочкой свободных электронов".
Свободные электроны могут двигаться свободно внутри металлической структуры и отвечают за электропроводность. Они играют роль неких "электрических зарядов", которые могут передаваться от атома к атому, образуя электрический ток. В результате этого, металлы имеют высокую электропроводность.
Металлическая структура обладает очень высокой плотностью свободных электронов, которые образуют своеобразное "море свободных электронов". Поэтому, при подключении внешнего электрического потенциала, свободные электроны очень легко двигаются по всей металлической структуре, обеспечивая электропроводность.
Таким образом, электропроводность металлов обусловлена особыми химическими связями - металлическими связями, которые обеспечивают наличие свободных электронов в металлической структуре и их способностью свободно двигаться и образовывать электрический ток.
Вопрос-ответ

Каким образом обеспечивается электропроводность металлов?
Электропроводность металлов обеспечивается наличием свободных электронов в их структуре. Каждый атом металла отдает один или несколько электронов на общую "поле" свободно двигающихся электронов. Именно эти свободные электроны возможно двигаются внутри металла под воздействием электрического поля и обеспечивают проводимость.
Почему металлы обладают высокой электропроводностью?
Металлы обладают высокой электропроводностью благодаря специфической структуре и свойствам их атомов. Атомы металла обладают слабыми связями между собой. Это позволяет электронам внутренней электронной оболочки, называемой "электрон-морем", свободно двигаться между атомами и передавать электрический заряд.
Что происходит при наличии электрического поля в металлах?
При наличии электрического поля в металлах, свободные электроны начинают двигаться под его воздействием. Это происходит из-за отталкивания электронов от положительно заряженных ионов металла. Таким образом, электрическое поле создает движение свободных электронов и обеспечивает электропроводность металла.
