Металлы и неметаллы - две основные группы химических элементов, имеющие ряд принципиальных различий. Металлы обладают такими характеристиками, как блеск и проводимость электричества, а неметаллы наоборот - не блестят и являются плохими проводниками электричества и тепла. Это связано с особенной структурой и способностью элементов образовывать связи между атомами.
Металлы обычно имеют металлическую структуру, которая характеризуется наличием свободных электронов, которые образуют так называемое "электронное море". Благодаря этому морю, металлы обладают высокой электропроводностью. Именно благодаря свободным электронам в металлах происходит явление металлического блеска.
Неметаллы, в свою очередь, формируют сетчатую структуру, то есть атомы неметалла связаны соседними атомами ковалентной связью. Поэтому неметаллы обычно не обладают проводимостью электропроводности. Кроме того, они не имеют блеска, поскольку свет, падающий на поверхность неметалла, рассеивается на его неровностях и структуре.
Очень важно отметить, что металлы и неметаллы образуют разные химические соединения. Металлы образуют ионные соединения с неметаллами, а неметаллы могут образовывать ковалентные соединения между собой.
Таким образом, химические особенности металлов и неметаллов определяются их структурой и способностью образовывать связи с другими атомами. Эти различия имеют важное значение для понимания химических процессов и свойств материалов, а также для применения металлов и неметаллов в различных областях науки и техники.
Взаимодействие металлов и неметаллов

Металлы и неметаллы взаимодействуют между собой, и такое взаимодействие имеет свои химические особенности. Один из основных принципиальных различий между металлами и неметаллами заключается в их склонности к окислению и восстановлению.
Металлы, как правило, обладают склонностью к окислению, то есть потере электронов. Если металл взаимодействует с неметаллом, то металл отдает электроны неметаллу, а сам превращается в ион положительной зарядности. Так, например, взаимодействие натрия (Na) и хлора (Cl) приводит к образованию ионов Na+ и Cl- и образованию хлорида натрия (NaCl).
Неметаллы, наоборот, имеют склонность к восстановлению, то есть к получению электронов. Если неметалл взаимодействует с металлом, то неметалл получает электроны, а металл превращается в ион отрицательной зарядности. Например, взаимодействие кислорода (O) и магния (Mg) приводит к образованию ионов O2- и Mg2+ и образованию оксида магния (MgO).
Таким образом, взаимодействие металлов и неметаллов основано на обмене электронами, что приводит к образованию ионов с противоположной зарядностью и образованию соединений между ними.
Реакции металлов с кислородом

Металлы обладают способностью реагировать с кислородом, что является одним из их характерных свойств. Реакция металлов с кислородом может проходить при различных условиях и приводит к образованию оксидов.
При нагревании металлы могут гореть в кислороде, образуя оксиды. Например, магний при взаимодействии с кислородом образует оксид магния с химической формулой MgO. Другой пример – алюминий, который при сгорании в кислороде образует оксид алюминия Al2O3.
Реакцию металлов с кислородом можно произвести и взаимодействием сильного окислителя – перекисью водорода. При этом металлы активно окисляются, образуя оксиды. Например, цинк при реакции с перекисью водорода образует оксид цинка ZnO.
Важно отметить, что не все металлы способны реагировать с кислородом при обычных условиях. Некоторые металлы, такие как золото и платина, являются химически инертными и практически не вступают в реакцию с кислородом.
Реакции металлов с кислородом имеют большое практическое значение и широко используются в различных отраслях промышленности, например, при производстве металлических окислов и других химических соединений. Степень реакции металла с кислородом зависит от его активности и условий, в которых проходит реакция.
Способы образования орто- и полихалогенидов
Орто- и полихалогениды образуются в результате химических реакций, в которых атомы галогенов (фтора, хлора, брома, йода) замещают один или несколько атомов в органических или неорганических соединениях.
Одним из способов образования орто- и полихалогенидов является химическая реакция алкилации, при которой атомы галогена замещают атомы водорода в органических соединениях. В результате реакции образуются соединения, в которых атомы галогена заместят один атом водорода (ортохлорбензол) или несколько атомов водорода (полихлорбензол) в молекуле.
Другим способом образования орто- и полихалогенидов является субституционная реакция, когда атомы галогена замещают атомы других элементов в неорганических соединениях. Например, в химической реакции между хлором и железом образуется полихлорид железа.
Также орто- и полихалогениды могут образовываться в результате взаимодействия галогена с алканами или алкенами. В результате этих реакций образуются соединения, в которых галогены замещают один или несколько атомов водорода в углеводородной цепи.
Проявление различной электроотрицательности
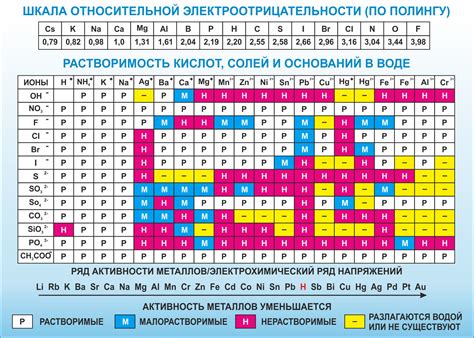
Металлы и неметаллы отличаются друг от друга величиной электроотрицательности. Электроотрицательность - это способность атома притягивать к себе электроны при образовании химической связи. У неметаллов электроотрицательность намного выше, что связано с их стремлением преобладать в химических реакциях и образовывать ионные связи.
Металлы, в свою очередь, имеют низкую электроотрицательность и, следовательно, оказывают большую силу притяжения на свои электроны. Это позволяет металлам образовывать металлические связи, в которых электроны делятся между атомами.
Наличие различной электроотрицательности приводит к тому, что металлы и неметаллы проявляют разные свойства при взаимодействии друг с другом. Например, металлы имеют способность отдавать свои электроны неметаллам, что приводит к образованию ионов и ионных связей. Неметаллы, в свою очередь, могут притягивать электроны и образовывать ковалентные связи, в которых электроны общие для обоих атомов.
Различная электроотрицательность также определяет положительный или отрицательный заряд ионов, образующихся при образовании химических соединений. Металлы образуют положительные ионы (катионы), отдавая электроны, а неметаллы образуют отрицательные ионы (анионы), принимая электроны.
Различия в химических свойствах галогенов и щелочных металлов

Галогены и щелочные металлы - это две основные группы элементов, имеющие существенные различия в химических свойствах.
Галогены, включающие фтор, хлор, бром, йод и астат, обладают высокой электроотрицательностью. Это означает, что они сильно притягивают электроны, образуя отрицательно заряженные ионы, называемые анионами. Галогены являются очень реактивными элементами и часто образуют соли, растворяющиеся в воде. Они часто принимают участие в окислительно-восстановительных реакциях и обладают высоким окислительным потенциалом.
С другой стороны, щелочные металлы - литий, натрий, калий, рубидий, цезий и франций - обладают низкой электроотрицательностью и имеют большую склонность отдавать электроны, образуя положительно заряженные ионы, называемые катионами. Щелочные металлы являются очень активными химическими элементами и вступают в реакции с многими другими элементами и соединениями. Они образуют щелочные оксиды и гидроксиды, которые легко растворяются в воде, образуя щелочные растворы.
Важно отметить, что галогены и щелочные металлы находятся в разных группах таблицы Менделеева и имеют различные химические свойства. Галогены образуют соединения с щелочными металлами, которые могут быть солью или галогенидом. Галогениды щелочных металлов обладают хорошей растворимостью в воде и могут быть использованы в различных химических процессах и промышленности.
Итак, различия в химических свойствах галогенов и щелочных металлов обусловлены их электроотрицательностью, склонностью к приобретению или отдаче электронов, а также способностью образовывать особые типы соединений. Эти различия делают галогены и щелочные металлы важными элементами в различных химических процессах и приложениях.
Образование ковалентных и ионных соединений
Ковалентные и ионные соединения являются двумя основными типами химических соединений, которые образуются между атомами. Они отличаются друг от друга по способу связывания атомов и их химическими свойствами.
Ковалентные соединения образуются, когда два или более неметаллических атома соединяются между собой путем обмена электронами. В этом типе связи электроны делятся между атомами, образуя общие "ковалентные" электронные пары. Ковалентные соединения имеют низкую температуру плавления и кипения, они обычно имеют малую электропроводность и химическую инертность.
Ионные соединения также образуются между атомами, но в этом случае образуется связь путем передачи электронов от одного атома к другому. В результате, один атом становится положительным ионом (катионом), а другой атом становится отрицательным ионом (анионом). Ионы притягиваются друг к другу электростатической силой, образуя ионную связь. Ионные соединения обычно обладают высокой температурой плавления и кипения, они могут проводить электрический ток в растворенном или расплавленном состоянии, и они обычно обладают химической реактивностью.
Вопрос-ответ

Какие химические особенности отличают металлы от неметаллов?
Металлы обычно образуют положительные ионы, имеют блестящую поверхность и хорошую теплопроводность. Неметаллы, наоборот, образуют отрицательные ионы, большинство из них имеют матовую поверхность и плохо проводят тепло.
Какие принципиальные различия во внешнем строении атомов у металлов и неметаллов?
Атомы металлов имеют малое количество электронов на внешней оболочке и склонны отдавать их, образуя положительные ионы. Атомы неметаллов, напротив, имеют большое количество электронов на внешней оболочке и склонны принимать дополнительные электроны, образуя отрицательные ионы.
Почему металлы обычно являются хорошими проводниками электричества и тепла?
Металлы обладают свободными электронами в своей структуре, которые могут легко перемещаться под влиянием электрического поля. Это делает их отличными проводниками электричества и тепла.
В чем особенность химической связи у металлов и неметаллов?
Между атомами металла и неметалла образуется ионная связь. Атом металла отдает электроны атому неметалла, образуя положительный ион металла и отрицательный ион неметалла. Эта связь обычно обладает высокой прочностью и стабильностью.
