Анодная защита – это метод, используемый для предотвращения коррозии металлических конструкций и оборудования, подверженных воздействию агрессивных сред. Этот метод основан на создании электрической разности потенциалов между защищаемым металлом и анодом, который является более активным металлом и служит источником электронов для защиты.
Важным параметром для эффективности анодной защиты является алгебраическая величина электродного потенциала металла. Этот параметр указывает на склонность металла к окислению или восстановлению и может быть положительным или отрицательным. Чем меньше алгебраическая величина электродного потенциала металла, тем больше его склонность к окислению и тем лучше будет его анодная защита.
Объяснение этого эффекта заключается в том, что более активные металлы имеют большую способность отдавать электроны, что позволяет им служить анодом в анодной защите. Если у металла отрицательная алгебраическая величина электродного потенциала, это означает, что он имеет большую способность принимать электроны и тем самым предотвращать его окисление.
Используя металл с меньшей алгебраической величиной электродного потенциала, можно добиться более эффективной анодной защиты. Этот подход применяется в различных отраслях промышленности, где коррозия металла является серьезной проблемой и может привести к серьезным повреждениям и даже авариям.
Алгебраическая величина электродного потенциала металла и его анодная защита

Алгебраическая величина электродного потенциала металла является важным показателем для определения эффективности его анодной защиты. Электродный потенциал металла характеризует его склонность к окислению или восстановлению при контакте с растворами или другими металлами.
Чем меньше алгебраическая величина электродного потенциала металла, тем лучше его анодная защита. Это связано с тем, что металл с более низким электродным потенциалом будет вступать в анодные реакции, т.е. окисляться, вместо того чтобы протекать коррозию.
Алгебраическая величина электродного потенциала металла отражает его химическую активность и способность к взаимодействию с окружающей средой. Чем больше по модулю этот потенциал, тем больше металл будет подвержен коррозии и тем слабее будет его анодная защита.
При проектировании систем анодной защиты, важно учитывать электродные потенциалы всех металлов, которые есть в данной системе. Если находятся рядом два металла с большой разницей в электродном потенциале, то это приводит к возникновению гальванических пар и сильному интенсивированию коррозии.
Поэтому для достижения эффективной анодной защиты, необходимо применять сопрягаемые с металлами аноды с более высоким электродным потенциалом для обеспечения их защиты от коррозии. Таким образом, знание электродных потенциалов металлов помогает определить и выбрать правильные компоненты для системы анодной защиты и обеспечить надежную защиту от коррозии.
Чем меньше электродный потенциал, тем лучше защита металла

Электродный потенциал металла является важным фактором, определяющим его способность к анодной защите. Чем меньше алгебраическая величина электродного потенциала, тем лучше защитные свойства металла.
Анодная защита — это метод предотвращения коррозии металла путем применения потенциала другого металла, который является более активным электрохимически. Металл с более низким электродным потенциалом играет роль анода и «жертвуется», тем самым защищая более ценный металл.
Низкий электродный потенциал означает, что металл склонен к окислительно-восстановительным реакциям, и поэтому он будет жертвовать собой в пользу другого, менее активного металла. Это позволяет сохранить более ценный материал от контакта с агрессивными средами и предотвращает его коррозию.
Для достижения наилучших результатов анодной защиты металла необходимо правильно подобрать материал, который имеет меньший электродный потенциал. Чем больше разница в потенциалах между анодом и катодом, тем эффективнее будет защита.
Также стоит отметить, что электродный потенциал металла может изменяться в зависимости от условий окружающей среды. Воздействие влаги, температуры, концентрации растворов и других факторов может изменить потенциал металла и, следовательно, его способность к анодной защите.
Влияние алгебраической величины электродного потенциала на анодную защиту
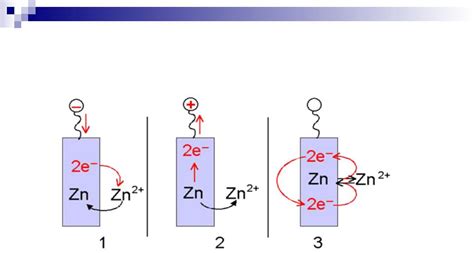
Электродный потенциал металла – это важный параметр, который оказывает влияние на эффективность анодной защиты. Алгебраическая величина этого потенциала позволяет оценить, насколько активен металл среди относительно пассивных металлов.
Чем меньше алгебраическая величина электродного потенциала металла, тем лучше его анодная защита. Металлы с более отрицательным потенциалом оказываются менее подвержены коррозии, так как они будут отдавать электроны более активным металлам в контакте с ними и, следовательно, сокращать собственную окисление.
Например, для железа, алгебраическая величина электродного потенциала равна -0,44 В. Это говорит о том, что железо является активным металлом и будет отдавать электроны более пассивным металлам при контакте, что снижает возможность коррозии.
Следовательно, при выборе материала для анодной защиты, необходимо учитывать алгебраическую величину электродного потенциала. Чем более отрицательное значение, тем лучше металл будет играть роль защитного анода, предотвращая коррозию основного металла.
Выбор металла для анодной защиты в зависимости от электродного потенциала
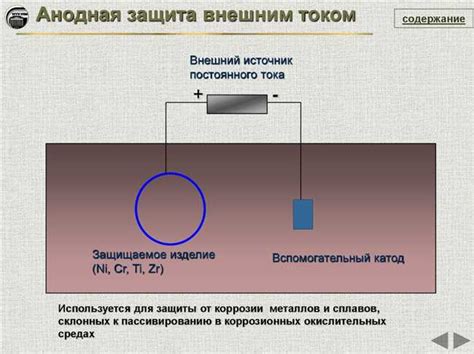
При проведении анодной защиты, важно правильно выбрать материал для анода - металлического элемента, который будет подвергаться коррозии вместо защищаемого объекта. При этом, одним из ключевых факторов при выборе металла является его электродный потенциал.
Электродный потенциал металла определяет его способность приобрести положительный или отрицательный заряд в химической реакции. Чем меньше алгебраическое значение электродного потенциала, тем лучше металл подходит для использования в системе анодной защиты. Низкий электродный потенциал означает, что металл будет более склонен отдавать электроны и станет "жертвой" коррозии.
При выборе металла для анодной защиты, предпочтительными являются металлы с более высокими электродными потенциалами, поскольку они будут служить электродами в реакции коррозии. Например, цинк имеет отрицательный электродный потенциал и часто используется в качестве анода при защите стали от коррозии.
Важно также учитывать, что электродные потенциалы металлов могут меняться в зависимости от рабочей среды, температуры и других факторов. Поэтому для точного выбора металла для анодной защиты необходимо учитывать конкретные условия эксплуатации и химические свойства среды.
В идеале, выбранный металл должен иметь низкий электродный потенциал и быть достаточно прочным и стойким к коррозии. Такой материал будет эффективно защищать объект от нежелательных электрохимических реакций и повысит его срок службы.
Вопрос-ответ

Что такое алгебраическая величина электродного потенциала металла?
Алгебраическая величина электродного потенциала металла является мерой его склонности к окислению или восстановлению в химических реакциях. Она определяется разницей между электродным потенциалом металла и стандартного водородного электрода. Положительная алгебраическая величина указывает на склонность к окислению, а отрицательная - к восстановлению.
Как связана алгебраическая величина электродного потенциала металла с его анодной защитой?
Связь между алгебраической величиной электродного потенциала металла и его анодной защитой состоит в том, что чем меньше алгебраическая величина электродного потенциала металла, тем больше потенциальная разница между ним и окружающим электролитом. Это позволяет электроду из металла вступать в реакцию с анодно-растворенными ионами и успешно выполнять свою защитную функцию, предотвращая коррозию металла.
