Металлы являются одним из основных компонентов нашего материального мира. Их активность – способность вступать в химические реакции – определяет их применение в различных сферах нашей жизни. Активность металла напрямую связана со скоростью его реакций с другими веществами.
Скорость реакции металлов зависит от ряда факторов, включая температуру, концентрацию реагентов, поверхность контакта и наличие катализаторов. Более активные металлы, такие как натрий и калий, имеют более высокую скорость реакций, чем менее активные металлы, такие как железо и медь.
Активность металла определяется его электрохимическим потенциалом, который подразумевает способность металла отдавать электроны при взаимодействии с другими веществами. Чем выше электрохимический потенциал металла, тем более активным он является.
Знание о скорости реакций металлов позволяет не только улучшить процессы его производства, но и снизить воздействие отрицательных химических реакций, таких как коррозия. Коррозия – процесс разрушения металла в результате его окисления в окружающей среде. Степень активности металла тесно связана с его склонностью к коррозии – более активные металлы склонны коррозировать быстрее.
Влияние скорости реакции на активность металла
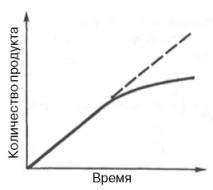
Скорость реакции является одним из главных параметров, определяющих активность металла. Активность металла определяется его способностью взаимодействовать с другими веществами и претерпевать химические изменения. Чем выше скорость реакции металла с окружающими веществами, тем более активным он считается.
Скорость реакции зависит от различных факторов, включая концентрацию реагентов, температуру, поверхность металла и наличие катализаторов. Реакция металла с окружающими веществами может протекать с разной скоростью в зависимости от этих факторов.
Высокая скорость реакции может указывать на высокую активность металла, так как это означает, что металл быстро и интенсивно взаимодействует с реагентами и может проводить химические изменения с высокой эффективностью. Например, если металл реагирует с кислородом атмосферы быстро и энергично, это говорит о его высокой активности.
Однако, активность металла не всегда напрямую связана со скоростью реакции. Некоторые металлы могут обладать высокой активностью, но проявлять низкую скорость реакции из-за наличия защитной оксидной пленки на поверхности. В таком случае, активность металла может быть оценена на основе его реакции с другими веществами, которые способны разрушить оксидную пленку и активизировать металл.
Таким образом, скорость реакции играет важную роль в определении активности металла, но она должна рассматриваться в сочетании с другими факторами, такими как концентрация реагентов, температура и поверхностные свойства металла, чтобы получить более полное представление о его активности.
Взаимосвязь активности металла с характером реакции
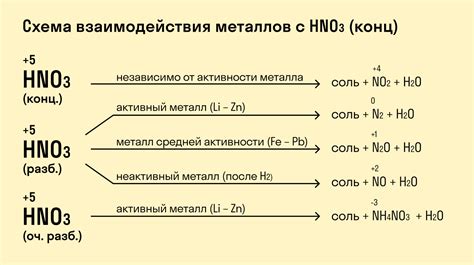
Активность металла описывает его способность вступать в химические реакции. Это свойство зависит от того, насколько легко металл может отдавать электроны при взаимодействии с другими элементами. Более активные металлы имеют большую склонность к реакциям, чем менее активные.
Характер реакции, в которой участвует металл, также зависит от его активности. Сильно активные металлы (например, натрий, калий) взаимодействуют с водой, выделяя водород и образуя гидроксид металла. Менее активные металлы (например, железо, медь) не реагируют с водой, но могут взаимодействовать с кислотами или другими веществами.
Активность металла также влияет на его способность к окислению или восстановлению. Более активные металлы обладают большей способностью к окислительным реакциям, тогда как менее активные металлы склонны к восстановительным реакциям.
Определение активности металла важно для определения его применимости в различных химических процессах. Более активные металлы могут использоваться в качестве катализаторов или в производстве электрической энергии, в то время как менее активные металлы могут быть полезны при создании конструкционных материалов или защитных покрытий.
Факторы, влияющие на скорость реакции металла

Скорость реакции металла зависит от нескольких факторов, которые оказывают непосредственное влияние на активность металла. Один из таких факторов - температура окружающей среды. При повышении температуры, скорость реакции металла увеличивается, поскольку повышение теплового движения атомов металла способствует их активации и возможности взаимодействия с другими веществами.
Еще одним фактором, влияющим на скорость реакции металла, является концентрация реагирующих веществ. При увеличении концентрации металла или реагента, участвующего в реакции, вероятность их столкновения увеличивается, что приводит к ускорению химической реакции.
Однако, помимо температуры и концентрации, на скорость реакции металла также влияет его поверхность. Чем больше площадь поверхности металла, тем большее количество его атомов имеет возможность вступить в реакцию. Из-за этого, мелко дисперсные металлические порошки, часто используемые в промышленности, обладают большей активностью, чем металлы в виде крупных кусков.
Некоторые металлы также способны каталитически активировать протекающую реакцию, увеличивая ее скорость без изменения самих веществ. Каталитическая активность металлов зависит как от их природы и структуры, так и от реагирующих веществ. Например, платина, никель и железо часто используются в качестве катализаторов в различных промышленных процессах.
Вопрос-ответ

Какая роль металла в реакции?
Металлы могут взаимодействовать с другими веществами и участвовать в химических реакциях. Они могут давать электроны (окисляться) или принимать электроны (восстанавливаться) во время химических реакций.
Как скорость реакции зависит от активности металла?
Скорость реакции зависит от активности металла. Более активные металлы обычно имеют более высокую скорость реакции. Это связано с тем, что активные металлы легче отдавать или принимать электроны, что способствует более быстрой реакции.
Что такое активность металла?
Активность металла - это его способность взаимодействовать с другими веществами и участвовать в химических реакциях. Она связана с способностью металла отдавать или принимать электроны во время реакции. Чем выше активность металла, тем более реакционноспособен он будет.
